
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成1molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
【答案】BD
【解析】
试题分析:A、电池:根据原电池的工作原理,阳离子移向正极,根据电池总电极反应式,Pb的化合价升高,Pb作负极,PbO2作阳极,H+移向PbO2电极;电解池:阳离子移向阴极,即H+移向Pb电极,故错误;B、电池:Pb电极反应式为Pb+SO42--2e-=PbSO4;电解池:2Al+6OH--6e-=Al2O3+3H2O,通过电子量相等,因此存在3Pb~6e-~Al2O3,每消耗3molPb,生成1molAl2O3,故正确;C、电池正极反应式为:PbO2 + 4H + + SO42- + 2e- = PbSO4 + 2H2O,电解池阳极反应式为:2Al + 6OH--6e- = Al2O3 + 3H2O,故错误;D、Pb电极反应式为:Pb + SO42--2e- = PbSO4,负极增量增大,电解池中Pb电极反应式2H2O + 2e- = H2↑ + 2OH-,Pb电极质量不变,故正确。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
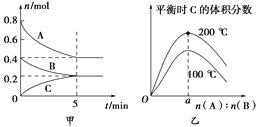
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A.原电池工作时化学能全部转化为电能
B.工业上电解氧化铝制备铝,电能转化成化学能
C.镁在空气中燃烧时化学能不只转变成热能
D.绿色植物光合作用过程中太阳能转变成化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个aL密闭容器中放入2mol A(气)和1mol B(气),在一定条件下发生下列反应:3A(气)+B(气) nC(气)+2D(气),达平衡后,A的浓度减少1/2,混和气体的式量增大1/8,则n的值为( )
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是( )
A. 聚乙烯塑料的老化是因为发生了加成反应
B. 农业上为了提高粮食的产量应大量使用化肥
C. 合成纤维、人造纤维及碳纤维都属于有机高分子材料
D. 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列5种有机物的沸点按由高到低的顺序排列正确的是( )
①2-甲基丁烷②2,2-二甲基丙烷③丙烷④四氯化碳⑤2-甲基丙烷
A. ①②③④⑤ B. ②③④⑤① C. ⑤②①③④ D. ④①②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的物质的量比乙的物质的量少
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。

请填写下列空白:
(1)电解饱和食盐水的离子方程式 。若用石墨作电极电解500 mL饱和食盐水,当两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)时,所得溶液的pH为 (假设反应前后溶液体积不变)。
(2)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(3)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填字母编号)
A.向正反应方向进行 B.向逆反应方向进行 C.处于平衡状态
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2 t。
(4)用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜(含铁、锌等杂质,如图),在接通电路一段时间后纯Cu质量增加6.4 g。

请写出电解精炼过程中杂质参加的一个电极反应: 。
②燃料电池正极消耗氧气的体积是 (标准状况)。
(5)氢气是合成氨气的重要原料。
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -908 kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com