
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,R-和Y+的简单离子相差8个电子。甲、乙化合物均含上述四种元素;常温下,0.01molL-1甲溶液的pH=2,0.01molL-1乙溶液的pH=a(2<a<7)。向乙溶液中滴加甲溶液,产生气体的物质的量与甲的物质的量关系如图所示(假设气体全部排出)。下列说法不正确的是( )
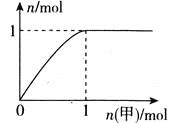
A.简单的离子半径:Z>X>Y
B.简单气态氢化物的热稳定性:X>Z
C.甲、乙中均含有离子键和共价键
D.常温下,甲、乙溶液中由水电离出的H+和OH-之间存在:c(H+)水c(OH-)水=1.0×10-14
【答案】D
【解析】
短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,![]() 和
和![]() 的简单离子相差8个电子,所以R是氢元素,Y是钠元素,甲、乙化合物均含上述四种元素,说明两种物质均为钠盐,0.01molL-1甲溶液的
的简单离子相差8个电子,所以R是氢元素,Y是钠元素,甲、乙化合物均含上述四种元素,说明两种物质均为钠盐,0.01molL-1甲溶液的![]() ,0.01molL-1乙溶液的pH范围是:
,0.01molL-1乙溶液的pH范围是:![]() ,说明甲是强酸的酸式盐,乙是弱酸的酸式盐,综上说明甲是硫酸氢钠,乙是亚硫酸氢钠,四种元素分别是氢、氧、钠、硫。
,说明甲是强酸的酸式盐,乙是弱酸的酸式盐,综上说明甲是硫酸氢钠,乙是亚硫酸氢钠,四种元素分别是氢、氧、钠、硫。
A. 简单的离子半径:硫离子大于氧离子大于钠离子,即![]() ,故A正确;
,故A正确;
B. 气态氢化物的热稳定性:水大于硫化氢,即![]() ,故B正确;
,故B正确;
C. 亚硫酸氢钠与硫酸氢钠溶液中都存在离子键和共价键两种化学键,故C正确;
D. 常温下甲、乙溶液中水的电离受到抑制,![]() ,故D错误。
,故D错误。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
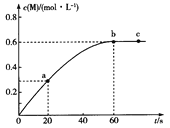
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH=__kJ·mol-1
CH3OH(g) ΔH=__kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是__(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1__p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=__(mol·L-1)-2;
③在其它条件不变的情况下,再增加amolCO和2amolH2,达到新平衡时,CO的转化率__(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到E点,可采用在水中加入少量碱的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=12的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。

下列说法正确的是
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,1 mol CO和2 mol H2O通入一个密闭容器中:CO(g)+H2O (g)![]() CO2(g)+H2(g),一定时间后达到平衡,此时,CO的含量为p%,若维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%的是( )
CO2(g)+H2(g),一定时间后达到平衡,此时,CO的含量为p%,若维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%的是( )
A.1 mol CO2、2 mol H2B.0.2 mol CO2、0.2 mol H2、0.8 mol CO、1.8 mol H2O
C.1 mol CO2、1 mol H2OD.1 mol CO2、 1 mol H2、 2 mol H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
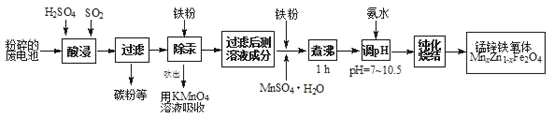
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
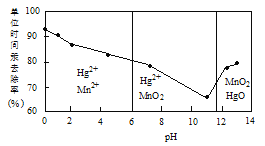
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如图,请根据要求填空:

(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③__________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x值应_________。
=x,若理论上欲获得最多的氯化氢,则x值应_________。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2![]() 2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是____________。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是___________。
(5)E装置的作用是____________ (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为_____________;该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____ (填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com