
| A. | 向漂白液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 用氨水吸收足量二氧化硫:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 用足量的氧氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| D. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
分析 A.碳酸钙为沉淀应保留化学式;
B.二氧化硫足量反应生成亚硫酸氢铵;
C.不符合反应客观事实;
D.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子.
解答 解:A.漂白粉溶液中通入少量CO2的离子方程式为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,故A错误;
B.用氨水吸收足量二氧化硫,离子方程式:SO2+NH3•H2O═HSO3-+NH4+,故B正确;
C.用足量的氧氧化钠溶液吸收二氧化氮,离子方程式:2NO2+2OH-═2NO3-+NO2-+H2O,故C错误;
D.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故D错误;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意离子反应遵循客观事实,题目难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
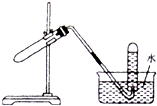
| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaC03(s)=BaO(s)+CO2(g)在高温下能自发进行,推知△H>0 | |
| B. | 2CO(g)=2C(s)+O2(g)是吸热反应,推知该反应在低温下能自发进行 | |
| C. | 4NH3(g)+5O2(g)=4N0(g)+6H2O(g)是放热反应,推知该反应能自迸行 | |
| D. | N2(g)+3H2(g)=2NH3(g)是熵减的放热反应,推知该反应在低温下能自迸行,但在实际生产中,为了保证反应速率,常采用高温、高压、催化剂等条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com