

分析 由转化关系可知,甲能发生连续氧化或与量有关的反应,
①若X为金属元素的单质,图中反应均为氧化还原反应,则X为Fe,甲为Cl2,乙为FeCl3,丙为FeCl2;
②若X为HCl,图中反应均为非氧化还原反应,则甲可能为Na2CO3或NaAlO2,反应均与盐酸的量有关,以此来解答.
解答 解:由转化关系可知,甲能发生连续氧化或与量有关反应,
①若X为金属元素的单质,图中反应均为氧化还原反应,则X为Fe,甲为Cl2,乙为FeCl3,丙为FeCl2,反应Ⅲ的化学方程式为Cl2+2FeCl2=2FeCl3,
故答案为:Fe;Cl2+2FeCl2=2FeCl3;
②若X为HCl,图中反应均为非氧化还原反应,则甲可能为Na2CO3或NaAlO2,
第一种,若甲为Na2CO3,反应Ⅲ的离子方程式为CO32-+CO2+H2O=2HCO3-,
第二种,若甲为NaAlO2,反应Ⅲ的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:Na2CO3;CO32-+CO2+H2O=2HCO3-;NaAlO2;3AlO2-+Al3++6H2O=4Al(OH)3↓.
点评 本题考查无机物的推断,为高频考点,把握元素化合物知识及物质的性质、相互转化等为解答的关键,侧重分析与推断能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、稀醋酸和蔗糖都是电解质 | |
| B. | 甲烷和乙烯均可使酸性KMnO4溶液褪色 | |
| C. | 纤维素、淀粉和蛋白质都是高分子化合物 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)利用原电池原理做如下实验:将一块白铁(镀锌)和一块马口铁(镀锡)上用小刀各划一道刻痕,露出里面的铁,向刻痕上各滴一滴NaCl溶液后,再各滴一滴K3[Fe(CN)6]溶液,放置在空气中,约10分钟观察到有一刻痕变蓝色.回答下列问题:
(1)利用原电池原理做如下实验:将一块白铁(镀锌)和一块马口铁(镀锡)上用小刀各划一道刻痕,露出里面的铁,向刻痕上各滴一滴NaCl溶液后,再各滴一滴K3[Fe(CN)6]溶液,放置在空气中,约10分钟观察到有一刻痕变蓝色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
. (并标出电子转移的方向与数目).
(并标出电子转移的方向与数目). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

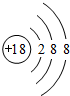 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com