
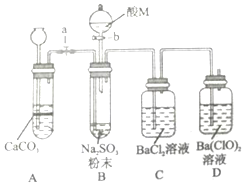
 SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:
SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:分析 装置中A是碳酸钙滴入盐酸生成二氧化碳的发生装置,从长颈漏斗加入适量盐酸生成二氧化碳是为了排净装置内生成的二氧化硫气体进入装置D吸收,装置B为二氧化硫气体发生装置,亚硫酸钠和浓硫酸反应生成,打开活塞a前,C中溶液有少量固体生成可能是生成的二氧化硫和空气中氧气在溶液中反应生成硫酸钡沉淀,长导管口有气泡.D中溶液有大量固体生成是次氯酸钡溶液中次氯酸根离子具有强氧化性能氧化进入的二氧化硫生成硫酸,生成硫酸钡沉淀,当C中长导管口无气泡后,D中液面上气体逐渐变为浅黄绿色是因为次氯酸根离子、氯离子在酸溶液中发生归中反应生成氯气,
(1)盛放酸M的仪器名称是分液漏斗;
(2)常温常压下,在1L水中大约最多能溶40L SO2,②H2SO3是中强酸利用强酸制备弱酸原理制备,稀溶液中会溶解二氧化硫,需要用浓度较大的硫酸;
(3)实验过程中,D中发生反应是酸溶液中次氯酸根离子氧化二氧化硫生成硫酸,结合钡离子形成白色沉淀硫酸钡,过量的次氯酸根离子和反应生成的氯离子在酸溶液中发生归中反应生成黄绿色气体氯气;
(4)实验步骤III的目的是利用生成的二氧化碳吧生成的二氧化硫全部赶入装置D中完全吸收;
(5)①先利用装置A生成的二氧化碳把装置内空气赶净再发生装置B中的反应,可以准确判断出装置C中的固体的成份;
②不足之处是无尾气吸收装置.
解答 解:检验装置的气密性,加入试剂,并按顺序组装仪器,关闭活塞a再打开旋塞b,分次加入酸M为浓硫酸和亚硫酸钠反应生成二氧化硫,待试管B中充分反应后,打开活塞a,从长颈漏斗加入适量盐酸利用生成的二氧化碳排净装置内生成的二氧化硫气体进入装置D吸收,
装置中A是碳酸钙滴入盐酸生成二氧化碳的发生装置,从长颈漏斗加入适量盐酸生成二氧化碳是为了排净装置内生成的二氧化硫气体进入装置D吸收,装置B为二氧化硫气体发生装置,亚硫酸钠和浓硫酸反应生成,打开活塞a前,C中溶液有少量固体生成可能是生成的二氧化硫和空气中氧气在溶液中反应生成硫酸钡沉淀,长导管口有气泡.D中溶液有大量固体生成是次氯酸钡溶液中次氯酸根离子具有强氧化性能氧化进入的二氧化硫生成硫酸,生成硫酸钡沉淀,当C中长导管口无气泡后,D中液面上气体逐渐变为浅黄绿色是因为次氯酸根离子、氯离子在酸溶液中发生归中反应生成氯气,
(1)盛放酸M的仪器是加入液体发生反应的仪器,名称是分液漏斗,故答案为:分液漏斗;
(2)查阅资料:①常温常压下,在1L水中大约最多能溶40L SO2,②H2SO3是中强酸.与亚硫酸钠反应制SO2的酸A最好用浓硫酸,故选d,
故答案为:d;
(3)实验过程中,D中发生反应是酸溶液中次氯酸根离子氧化二氧化硫生成硫酸,结合钡离子形成白色沉淀硫酸钡,过量的次氯酸根离子和反应生成的氯离子在酸溶液中发生归中反应生成黄绿色气体氯气,反应的离子方程式为:Ba2++3ClO-+SO2+H2O=BaSO4↓+Cl-+2HClO,Cl-+ClO-+2H+=Cl2↑+H2O,
故答案为:Ba2++3ClO-+SO2+H2O=BaSO4↓+Cl-+2HClO,Cl-+ClO-+2H+=Cl2↑+H2O;
(4)实验步骤III的目的是利用装置A中盐酸和碳酸钙发生反应生成的二氧化碳气体把装置B中生成的二氧化硫全部赶入装置D中完全吸收,
故答案为:利用装置A生成的二氧化碳气体把残留在装置内的二氧化硫驱赶至D中充分吸收;
(5)①甲同学的实验步骤设计不严谨,所以装置C中的少量固体可能是:亚硫酸钡、硫酸钡或亚硫酸钡和硫酸钡.为确定C中固体的成分,乙同学在不改变实验装置的条件下,只对实验步骤加以改进便能准确判断出装置C中的固体的成份.乙同学对实验步骤改进的具体操作是:步骤Ⅰ后,打开活塞a,从长颈漏斗加入稀盐酸利用生成的二氧化碳排净装置内的空气,
故答案为:步骤Ⅰ后,打开活塞a,从长颈漏斗加入稀盐酸利用生成的二氧化碳排净装置内的空气;
②甲同学的实验装置有明显不足,缺少尾气吸收装置,故答案为:缺尾气吸收装置.
点评 本题考查了装置中仪器的作用、物质性质的实验验证和反应现象分析,主要是物质制备和物质性质的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2 在水中的溶度积比其在 Cu(NO3)2 溶液中的大 | |
| B. | 一定温度下,将 0.10 mol/L的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应的离子方程式为:H3PO2+3OH?═PO23-+3H2O | |
| D. | 常温下,NaHS 溶液中:c(H+)+c(H2S)═c(S2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com