
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
②CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
③2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1,
根据盖斯定律,①+②×2-2×③可得:CO2(g)+CH4(g)═2CO(g)+2H2(g),反应的焓变也进行相应的计算;
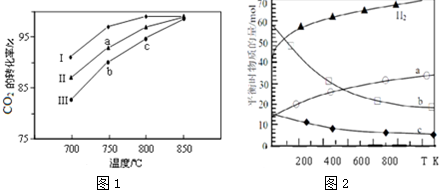
(2)①催化剂只能改变反应速率,不能改变化学平衡,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CO2的转化率相同;
②b、c点均未达到平衡状态,升高温度,化学反应速率加快,CO2的转化率较大;
(3)①反应是气体物质的量减小的反应,混乱度减小;
②Kp等于各产物平衡分压系数次方的乘积和各个反应物平衡分压系数次方乘积的比值;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或提高氢气和二氧化碳物质的量的比值等.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
②CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
③2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1,
根据盖斯定律,①+②×2-2×③可得:CO2(g)+CH4(g)═2CO(g)+2H2(g),则△H=(a+2b-2c)kJ•mol-1,
故答案为:(a+2b-2c);
(2)①催化剂只能改变反应速率,不能改变化学平衡,所以不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CO2的转化率相同,故a点所代表的状态不是平衡状态,
故答案为:不是;
②b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大;
故答案为:b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大;
(3)①反应是气体物质的量减小的反应,混乱度减小,则△S<0,故答案为:<;
②该反应的Kp等于各产物平衡分压系数次方的乘积和各个反应物平衡分压系数次方乘积的比值,即KP=$\frac{p({C}_{2}{H}_{4})×{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})×{p}^{6}({H}_{2})}$,
故答案为:$\frac{p({C}_{2}{H}_{4})×{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})×{p}^{6}({H}_{2})}$;
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或提高氢气和二氧化碳物质的量的比值,
故答案为:增大压强;提高氢气和二氧化碳物质的量的比值.
点评 本题考查较为综合,涉及化学平衡的影响、图象分析、反应热计算以及化学平衡常数等,为高频考点和常见题型,需要学生具备扎实的基础,侧重考查阅读获取信息能力、分析解决问题的能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 2CO(g)═2C(s)+O2(g) | B. | NH4Cl(s)=NH3(g)+HCl(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com