
科目:高中化学 来源: 题型:选择题
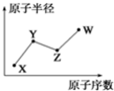 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | X、Y、Z三种元素形成的化合物均为强酸 | |
| C. | Y的氢化物可用于检验W的单质是否泄漏 | |
| D. | 如W的单质泄漏,可以用湿毛巾蘸Y的氢化物的水溶液逃生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 | |
| C. | Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 | |
| D. | 水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染 | |
| B. | 二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸 | |
| C. | 两种气体都具有强氧化性,因此都能够使品红溶液褪色 | |
| D. | 两种气体溶于水都可以与水反应,且只生成相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com