
| A. | 原溶液一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 若要证明原溶液中是否存在 Cl-,可在第①步的滤液中加硝酸酸化后再加硝酸银溶液 | |
| C. | 加Ba(OH)2溶液中使原溶液中的离子恰好反应且完全沉淀时,混合液呈中性 | |
| D. | 第②步实验中共消耗0.04mol HCl |
分析 由①取100mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g.
②向沉淀中加入过量的盐酸,有2.33g沉淀不溶解,
可知2.33g为硫酸钡,一定含SO42-为$\frac{2.33g}{233g/mol}$=0.01mol,4.88g沉淀为硫酸钡和其它沉淀的混合物,离子浓度均相等,沉淀若为碳酸钡,则含HCO3-,碳酸钡的质量为0.01mol×197g/mol=1.97g<4.88g-2.33g,则沉淀还含为氢氧化镁,则含Mg2+为$\frac{2.55g-1.97g}{58g/mol}$=0.01mol,结合电荷守恒来解答.
解答 解:由上述分析可知一定含SO42-、HCO3-、Mg2+,由电荷守恒可知,一定含Na+、K+中的一种,不能确定是否含Cl-,若Na+、K+均存在,则含Cl-,
A.一定存在SO42-、HCO3-、Mg2+,由电荷守恒可知,至少存在Na+、K+中的一种,故A正确;
B.SO42-、Cl-均反应生成白色沉淀,第①步的滤液中不含硫酸根离子,加入硝酸酸化的硝酸银溶液能检验,故B正确;
C.发生Ba2++SO42-=BaSO4↓、Ba2++OH-+HCO3-=BaCO3↓+H2O-,生成碱及水解显碱性的盐,溶液显碱性,故C错误;
D.0.01molMg(OH)2、0.01molBaCO3均与盐酸以1:2反应,共消耗0.04mol HCl,故D正确;
故选C.
点评 本题考查常见离子的推断,为高频考点,把握离子之间的反应、现象为解答的关键,侧重分析与推断能力的考查,注意电中性的应用,沉淀成分的推断为突破口,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z形成的化合物不止一种 | |
| B. | X的氢化物比Y的氢化物稳定 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL,56.2g | B. | 500mL,56.2g | C. | 500mL,58.5g | D. | 任意规格,56.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据所学知识完成下列填空.
根据所学知识完成下列填空.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
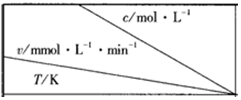 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 | |
| B. | 铜导线替换盐桥,原电池仍继续工作 | |
| C. | 开始时,银片上发生的反应是Ag-e-═Ag+ | |
| D. | 电子通过盐桥从乙池流向甲池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW/C(OH-)=10-12mol•L-1的溶液中:Na+、K+、SiO32-、Cl- | |
| B. | 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| C. | 由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液中:Na+、CO32-、SO32-、Cl- | |
| D. | 使KSCN显红色的溶液中:NH4+、K+、Cl-、A1O2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com