

| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
| 1.12L |
| 22.4L/mol |
| 1 |
| 2 |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、导致易拉罐变瘪的反应是:CO2+2OH-=CO32-+H2O |
| B、导致易拉罐又鼓起来的反应是:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| C、取易拉罐内反应后的溶液,逐滴加入足量的盐酸,只能发生3个化学反应 |
| D、如果将CO2换为NH3,浓NaOH溶液换为浓盐酸,易拉罐也会出现先瘪后鼓的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
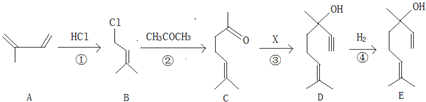
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| B、1L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
| C、0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA |
| D、常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
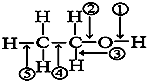
| A、和金属钠作用时,键①断裂 |
| B、和浓硫酸共热至170℃时,键②和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键②断裂 |
| D、在银催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com