
分析 n(Cu)=$\frac{25.6g}{64g/mol}$=0.4mol,浓硫酸和铜反应方程式为Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,
(1)根据被还原硫酸和二氧化硫之间的关系式计算;
(2)由方程式SO2+2NaOH=Na2SO3+H2O分析得SO2过量,过量的SO2还能继续反应,此方程式为Na2SO3+H2O+SO2=2NaHSO3根据这两个方程式计算溶质Na2SO3,NaHSO3,并注意应根据不足量的物理量作为标准进行计算.
解答 解:n(Cu)=解:n(Cu)=$\frac{25.6g}{64g/mol}$=0.4mol,浓硫酸和铜反应方程式为Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,
(1)∵由方程式知其中2H2SO4被还原的H2SO4为1分子
∴二氧化硫之间的关系式为H2SO4----SO2,消耗0.1mol硫酸
∴n(SO2)=0.1mol
V(SO2)=n(SO2)Vm=0.1mol×22.4L/mol=2.24L,
答:生成气体在标况下体积为2.24L;
(2)n(NaOH)=C(NaOH)V=1mol/L×0.15L=0.15mol
由方程式①知SO2过量,所以应将不足的NaOH作为计算对象.
SO2+2NaOH=Na2SO3+H2O①
1 2 1
0.075 0.15 0.075
Na2SO3+H2O+SO2=2NaHSO3②
1 1 2
0.025 1-0.075 0.05
n(Na2SO3)=0.075mol-0.025mol=0.05mol
n(NaHSO3)=0.05mol
答:则反应结束后溶液中溶质Na2SO3,NaHSO3及其物质的质量分别为0.05mol,0.05mol.
点评 本题考查了根据方程式的计算,根据方程式中各个物理量的关系式进行计算,易错点是(2)中要进行过量计算,根据不足量的物理量为标准进行计算,题目难度中等.


科目:高中化学 来源: 题型:解答题

 .
.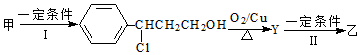
 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Fe | B. | Zn、Ag | C. | Fe、Zn | D. | Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ①②③④ | C. | ①②③⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:2 | B. | 1:4:1 | C. | 4:4:1 | D. | 4:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KMnO4溶液鉴别甲烷和乙烯 | |
| B. | 用焰色反应鉴别KNO3和KCl | |
| C. | 用BaCl2溶液鉴别Na2CO3和Na2SO4 | |
| D. | 用NaOH溶液除去Cl2中含有的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com