
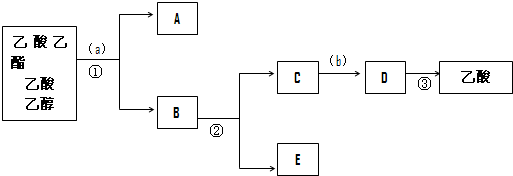
分析 由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法分离,则A为乙酸乙酯,B为水层含有乙醇、乙酸钠,利用蒸馏方法分离出乙醇,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,故E为乙醇,C为乙酸钠,D为乙酸,以此解答该题.
解答 解:由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法分离,则A为乙酸乙酯,B为水层含有乙醇、乙酸钠,利用蒸馏方法分离出乙醇,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,故E为乙醇,C为乙酸钠,D为乙酸,
(1)由上述分析可知,A为乙酸乙酯,B为乙醇、乙酸钠;E为乙醇,故答案为:乙酸乙酯;乙酸钠、乙醇;乙醇;
(2)加入饱和碳酸钠溶液a,溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来,
故答案为:饱和碳酸钠溶液;硫酸;
(3)由上述分析可知,操作①是分液,操作②是蒸馏,操作③是蒸馏,故答案为:分液;蒸馏.
点评 本题考查有机物推断、有机物的分离提纯、乙酸乙酯的制备等,侧重考查有机物分离提纯,关键是理解分离提纯原理,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | Na[Al(OH)4]溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的平均分子质量不变 | B. | 密闭容器中总压强不变 | ||
| C. | 混合气体的密度不变 | D. | 密闭容器中CO2的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  | 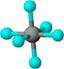 | 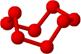 |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
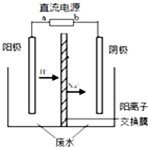 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com