
| A、生成了一种强酸弱碱盐 |
| B、弱酸溶液与强碱溶液反应 |
| C、强酸溶液与强碱溶液反应 |
| D、一元强酸溶液和一元强碱溶液反应 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
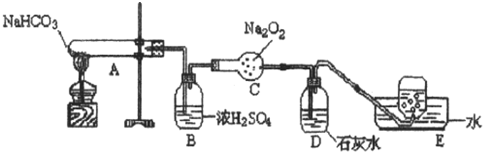
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂可以改变化学反应的活化能,但不改变反应的晗变 |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、50℃时,pH=11的纯碱溶液中c(OH-)=1.0×10-3mol?L-1 |
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在常温时向右进行,加热时向左进行,是因为该正向△H>0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入烧碱溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
| B、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO2-+H2O |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| D、FeCl2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、混合溶液中,c(H+)=
| ||
| C、a=b | ||
| D、混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2SO2+O2?2SO3的平衡体系中,加入由18O构成的氧气,则SO2中的18O的含量会增加 | ||||||
B、 I2(g)+H2(g)?2HI(g)加压后颜色加深 I2(g)+H2(g)?2HI(g)加压后颜色加深 | ||||||
C、
| ||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述I | 陈述II |
| A | SO2和氯水有漂白性 | 两者都能使溴水褪色 |
| B | 用淀粉-KI鉴别FeCl2 | Fe2+有氧化性 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com