
【题目】在1 L的密闭容器中,发生反应4A(固)+3B(气)![]() 2C(气)+D(气),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(气)+D(气),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用B、C、D分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 再过2 min,B的浓度仍减少0.6 mol·L-1
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,则下列说法正确的是
A. 15g甲基(-CH3)所含有的电子数是10NA
B. 常温常压下,4g氦气所含有的原子数目为NA
C. 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为(5/22.4)NA
D. 常温常压下,1mol丙烷所含有的共价键数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol H—N键吸收的能量为391 kJ,根据化学方程式:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是
2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是
A. 431 kJB. 945.6 kJC. 649 kJD. 869 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
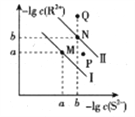
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol,完全燃烧得0.12molCO2和0.2molH2O,则混合气体中( )
A.一定有甲烷B.一定有乙烯C.一定有乙烷D.一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)图是等质量的Na2CO3、NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较多的试管中加入的固体试剂是_______________,当反应结束时,A、B两试管中消耗的盐酸中HCl的质量之比为______________。


(2)实验过程中我们还能感受到Na2CO3与盐酸反应时是放热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B两试管的反应过程中,反应体系的能量变化的总趋势A对应于右下图____________。(填“m”或“n”)
(3) 在火箭点火时,肼(N2H4)与四氧化二氮发生反应,产生两种广泛存在的无毒无害的物质,写出该反应的化学方程式 _____________________________________________。
Ⅱ某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。

(1)使用时,空气从________(填“A”或“B”)口通入。
(2)假设使用的“燃料”是甲醇(CH3OH),总反应式为2CH3OH+4OH-+3O2= 2CO32-+6H2O,则A口加入的物质为______________(填名称)。
(3)a极反应式为_________________________________________________。
(4)当电路中通过0.3 mol电子时,消耗甲醇的质量为_____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com