
 ����һ����Ҫ�Ļ���ԭ�ϣ�Ҳ����Ҫ�Ĺ�ҵ��Ʒ���ڹ�ũҵ������������������Ҫ���ã�
����һ����Ҫ�Ļ���ԭ�ϣ�Ҳ����Ҫ�Ĺ�ҵ��Ʒ���ڹ�ũҵ������������������Ҫ���ã����� ��1������ˮ���ƣ�Ҳ�ܷ������룺NH3+NH3=NH4++NH2-����2.3g������Ͷ��1.0LҺ���л���NH2-���ٽ�Һ���ĵ��룬����Һ����Ӧ����NaNH2����ϻ�ѧ����ʽ���㣻
��2����Pt�缫��Һ�����е��ɲ���H2��N2�������ϰ�����笠����ӵõ��������������������ǰ�����-3�۵ĵ�ʧ�������ɵ�����
��3��N2��g����H2��g����CO2��g����Ӧ����CO��NH2��2��s����H2O��l�������Է�Ӧ�ķ���ʽΪ��N2��g��+3H2��g��+CO2��g���TCO��NH2��2��s��+H2O��l�����ɸ�˹���ɷ������
��4�����N2Ϊ0.10mol��H2Ϊ0.30mol��NH3Ϊ0.10mol�����ݷ���ʽ֪���μӷ�Ӧ���������ʵ���=0.15mol����H2��ƽ��ת����=$\frac{�μӷ�Ӧ���������ʵ���}{������ʼ���ʵ���}$��100%��ƽ����c��N2��=0.10mol/L��c��H2��=0.30mol/L��c��NH3��=0.10mol/L���ڸ��¶��µ�ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$��
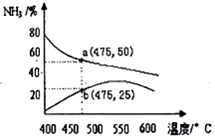
��5������ͼ֪��a��ƽ�����ߡ�b�Ǿ���һ��ʱ�䷴Ӧ������ߣ����¶���Ҫʹ�÷�Ӧ�ﵽƽ��״̬��Ӧ��������������ƽ�������ƶ���
��� �⣺��1����2.3g������Ͷ��1.0LҺ���з�����ӦΪ��2Na+2NH3=2NaNH2+H2�����ٽ�Һ���ĵ��룬���ݣ�NH3+NH3=NH4++NH2-��[NH4+][NH2-]=l.0��l0-30����Ӧ����NH2-���ʵ���Ϊ0.1mol��Ũ��Ϊ0.1mol/L��������Һ��NH4+��Ũ��l.0��l0-29mol/L��
�ʴ�Ϊ��1.0��l0-29mol/L��
��2����Pt�缫��Һ�����е��ɲ���H2��N2�������ϰ�����笠����ӵõ��������������缫��ӦʽΪ2NH3+2e-=H2+2NH2- �� 2NH4++2e-=H2+2NH3��
�����ĵ缫��ӦʽΪ��8NH3-6e-=N2��+6NH4+�� 6NH2--6e-=N2��+4NH3���ʴ�Ϊ��8NH3-6e-=N2��+6NH4+�� 6NH2--6e-=N2��+4NH3��
��3��N2��g����H2��g����CO2��g����Ӧ����CO��NH2��2��s����H2O��l�������Է�Ӧ�ķ���ʽΪ��N2��g��+3H2��g��+CO2��g���TCO��NH2��2��s��+H2O��l�������ݢ�N2��g��+3H2��g���T2NH3��g����H=-92.4kJ•mol-1��
��2NH3��g��+CO2��g���TNH2CO2NH4��s����H=-159.47kJ•mol-1��
��NH2CO2NH4��s���TCO��NH2��2��s��+H2O��l����H=+72.49kJ•mol-1��
�ɸ�˹���ɿ�֪����+��+�۵ã�N2��g��+3H2��g��+CO2��g���TCO��NH2��2��s��+H2O��l����H=-179.38 kJ•mol-1���ʴ�Ϊ��N2��g��+3H2��g��+CO2��g���TCO��NH2��2��s��+H2O��l����H=-179.38 kJ•mol-1��
��4�����N2Ϊ0.10mol��H2Ϊ0.30mol��NH3Ϊ0.10mol�����ݷ���ʽ֪���μӷ�Ӧ���������ʵ���=0.15mol����H2��ƽ��ת����=$\frac{�μӷ�Ӧ���������ʵ���}{������ʼ���ʵ���}$��100%=$\frac{0.15mol}{0.3mol+0.15mol}$��100%=33.3%��ƽ����c��N2��=0.10mol/L��c��H2��=0.30mol/L��c��NH3��=0.10mol/L���ڸ��¶��µ�ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0.1{0}^{2}}{0.10��0.3{0}^{3}}$=3.70��
�ʴ�Ϊ��33.3%��3.70��
��5������ͼ֪��a��ƽ�����ߡ�b�Ǿ���һ��ʱ�䷴Ӧ������ߣ����¶���Ҫʹ�÷�Ӧ�ﵽƽ��״̬��Ӧ��������������ƽ�������ƶ���������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ������
���� ���⿼�黯ѧƽ���йؼ��㼰���ԭ����Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷ��ѧƽ����㷽�������ԭ���ǽⱾ��ؼ����ѵ��ǣ�5���⣬���������Ũ����Դ�Сȷ����Ӧ������Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����еķ���������� | B�� | �����еķ��Ӽ����С | ||
| C�� | �����еķ�������ı� | D�� | �����еķ�����Ŀ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú�ĸ����ʯ�͵ķ������ڻ�ѧ�仯 | |
| B�� | ʯ���ѻ���õIJ�Ʒ�ǻ���� | |
| C�� | ʯ����Ҫ��C��H��O����Ԫ�� | |
| D�� | ú���;�������ɵõ������ױ��ȣ�˵��ú�к��б��ͼױ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
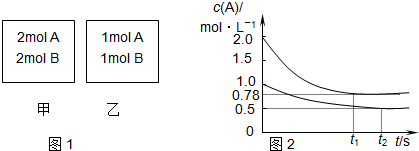
| A�� | x=1 | |
| B�� | ���������������¿�ʹ�������ڸ����ʵ����������������ڵ���ͬ | |
| C�� | ������������ٳ���2 mol A��2 mol B����ƽ��ʱ�������У�0.78 mol•L-1��c��A����1.56 mol•L-1 | |
| D�� | ��������Ϊ��ѹ�ɱ�����������г���������壬��c��A����С��ƽ�������ƶ���v��������v���棩�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.5 mol NO2��������H2O��Ӧ��ת�Ƶĵ�����ΪNA | |
| B�� | ���³�ѹ�£�0.5NA��CO2��������Ϊ22 g | |
| C�� | 1 mol/L��CH3COOH��CH3COO-��Ũ��С��1 mol/L����1 mol/L CH3COONa��CH3COO-����1 mol/L | |
| D�� | 18g 18O2�к��е�������Ϊ10NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������κ�ˮ�ķ�Ӧ�����кͷ�Ӧ | |
| B�� | ������֮��һ�����ܷ�����Ӧ | |
| C�� | ����һ�ֵ��ʺ�һ�ֻ�����ķ�Ӧһ�����û���Ӧ | |
| D�� | ���ֽⷴӦһ��û�е��ʲμ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��AlCl3��Һ��Al2��SO4��3��Һ�ֱ���ȡ����ɡ����գ����ù���ɷ���ͬ | |
| B�� | ����FeSO4��Һʱ����FeSO4��������ϡ�����У�Ȼ��ϡ��������Ũ�� | |
| C�� | �÷�Һ�ķ��������Ҵ���ˮ�Ļ����Һ | |
| D�� | ϴ�����۳����ȵ�Na2CO3��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com