
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.107 g Fe(OH)3胶体中胶体粒子的数目为NA
B.1 L 0.1 mol·L-1Na2CO3溶液中CO32-和HCO3-的离子数之和为0.1NA
C.常温常压下,3.6 g D2O与H218O中含有中子数2NA
D.30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA
【答案】D
【解析】
A.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故107g氢氧化铁即1mol氢氧化铁所形成的胶粒的个数小于NA个,故A错误;
B.CO32-在溶液中部分水解为HCO3-和H2CO3,故1 L 0.1 mol·L-1Na2CO3溶液中的CO32-、HCO3-和H2CO3之和为0.1NA个,CO32-和HCO3-离子数之和小于0.1NA,故B错误;
C. 常温常压下,3.6 g D2O与H218O中含有中子数为![]() =1.8NA,故C错误;
=1.8NA,故C错误;
D.14C2H2和C18O的摩尔质量均为30g/mol,故30g混合物的物质的量为1mol,而两者中均含14个质子,故1mol混合物中含14NA个质子,与两者的比例无关,故D正确;
答案:D


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
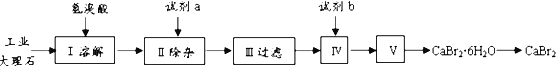
回答下列问题:
(1)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是___________,控制溶液的pH约为8.0的目的是___________、___________。
(2)试剂b是___________,步骤IV的目的是_______。
(3)步骤V所含的操作依次是________________、过滤。
(4)制得的溴化钙可以通过如下步骤测定其纯度:
称取4.00g无水溴化钙样品;溶解;滴入足量Na2CO3溶液,充分反应;过滤;烘干;冷却。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中正确的是
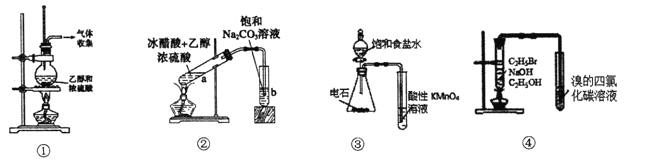
A. 装置①:实验室制取乙烯
B. 装置②:实验室制取乙酸乙酯
C. 装置③:验证乙炔的还原性
D. 装置④:验证溴乙烷发生消去反应可生成烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)书写下列物质电子式
①NaOH:_______;②CO2:______;③H2O2:_____;
(2)用电子式表示下列物质的形成过程
①MgCl2:________;
②H2O:__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):
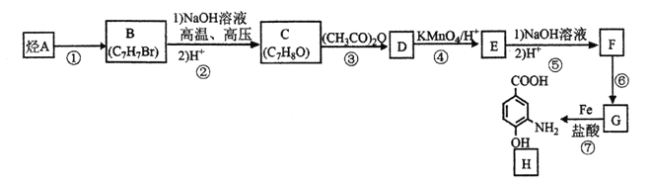
已知:①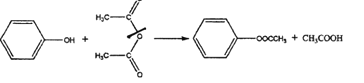
②![]()
请回答下列问题:
(1)H的分子式是___。反应①的试剂和反应条件是___。反应③的类型是__。
(2)E的结构简式是_____。
(3)写出B到C第一步反应的化学方程式是_____。
(4)设计C→D和E→F两步反应的共同目的是____。
(5)F的同分异构体中能同时满足下列条件的共有____种(不含立体异构):①遇FeCl3溶液显紫色,②能发生银镜反应;其中核磁共振氢谱为4组峰的是____(写出其中一种的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
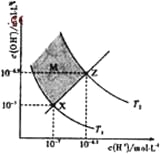
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是
A. Al3+、Mg2+、SO![]() B. Mg2+、CO
B. Mg2+、CO![]() 、I-
、I-
C. Al3+、SO![]() 、I- D. Al3+、Br-、SO
、I- D. Al3+、Br-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
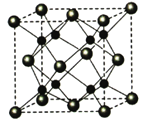
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt 易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A. ①③④⑤ B. ①④⑤ C. ③④⑤⑦ D. ①③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com