

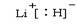
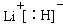 。
。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
| B.短周期元素形成离子后,最外层均达8电子稳定结构 |
| C.多电子原子中,在离核较近的区域运动的电子能量较低 |
| D.Cl、 S、P得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | | | |
| | | Y | Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+<Mg2+<Al3+<O2- | B.S2->Cl->Na+>Al3+ |
| C.Na<Mg<Al<S | D.Ca<Rb<K<Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HF的稳定性比HCl强 |
| B.Mg失电子能力比Ca弱 |
| C.NaCl与NH4Cl含有的化学键类型相同 |
| D.等物质的量的H2S和H2O2含电子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com