

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:填空题
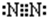 ,其中的化学键属于共价键(填“离子”或“共价”).
,其中的化学键属于共价键(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定量检验C2H5Cl时,将C2H5Cl和NaOH溶液混合共热后,加盐酸酸化 | |
| B. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 | |
| C. | 鉴定检测液中是否有Fe2+时,用硝酸酸化,再加KSCN溶液 | |
| D. | 鉴别溶液中是否含有SO42-可用盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com