
| A. | 燃煤时加入石灰石,可减少硫氧化物的排放 | |
| B. | 氯水中加入适量石灰石,可增强氯水的漂白性 | |
| C. | 酸性土壤中加入适量的熟石灰,可以中和其酸性 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)中施用熟石灰,可降低土壤的碱性 |
分析 石灰石主要成分为碳酸钙,可与酸、盐等反应,熟石灰为氢氧化钙,可与酸发生中和反应,与碳酸盐反应可生成碳酸钙沉淀,以此解答该题.
解答 解:A.石灰石可与二氧化硫反应生成亚硫酸钙,最终生成硫酸钙,可减少硫氧化物的排放,故A正确;
B.氯水中加入适量石灰石,盐酸与石灰石反应,而HClO不反应,促进氯气与水的反应,HClO浓度增大,漂白性增强,故B正确;
C.酸性土壤中加入适量的熟石灰,可发生中和反应生成碳酸钙,故C正确;
D.盐碱地(含较多NaCl、Na2CO3)中施用熟石灰,生成碳酸钙和氢氧化钠,碱性增强,故D错误.
故选D.
点评 本题考查碳酸钙、熟石灰的性质以及应用,为高频考点,侧重考查学生的双基知识,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 有机物 | 水杨酸 | 冬青油 | 阿司匹林 |
结构简式 |  |  | 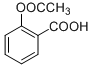 |
| A. | 可以用FeCl3溶液鉴别冬青油和阿司匹林 | |
| B. | 由水杨酸制冬青油的反应是取代反应 | |
| C. | 1mol阿司匹林最多能与3 mol NaOH反应 | |
| D. | 可以用碳酸钠溶液除去冬青油中少量的水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 人造纤维、合成纤维和光导纤维都是有机离分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 可用Si2N4、Al2O3制作高温结构陶瓷制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 在0.1mol/L的NaOH溶液中,由水电离出的c(H+)>$\sqrt{{K}_{W}}$ | |
| C. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| D. | CH3COONa和盐酸两溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 离子方程式2Ca2++3HCO3-+3OH-═2CaCO3↓+CO32-+3H2O可以表示NH4HCO3与澄清石灰水反应 | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | n[NH4AlSO4)2]:n[Ba(OH)2]=2:5 时发生的反应为NH4+Al3++2SO42-+2Ba2++5OH-═NH3•H2O+AlO2-+2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X=5则HA为强酸 | |
| B. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$ 减小 | |
| C. | 由b到c,Kw不变 | |
| D. | a、c两溶液中n(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y形成的阴离子有XY32-、X2Y42- | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Q与Y可形成一种高效安全灭菌消毒剂 | |
| D. | W的最高价氧化物对应水化物的酸性比Q的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com