
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 1×10-17 | 8×10-16 | 4×10-38 |
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法可以除去食盐水中的泥沙 | |
| B. | 酒精灯加热烧瓶时不用垫石棉网 | |
| C. | 氯化氢气体能使干燥的蓝色石蕊试纸变红 | |
| D. | 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
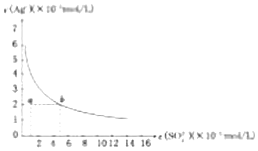
| A. | 在SO42-浓度为3mol/L的溶液中肯定不存在Ag+ | |
| B. | 0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | 在任何存在Ag2SO4的悬浊溶度积中c(Ag+)=2c(SO42-) | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③ | C. | ①②③⑤ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物都能溶于水,而共价化合物都不溶于水 | |
| B. | 离子化合物的熔点一般较高,而共价化合物的熔点一般较低 | |
| C. | 离子化合物的硬度一般较大,而共价化合物的硬度一般较小 | |
| D. | 离子化合物在熔融条件下能够导电,而共价化合物在熔融条件下不能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com