
A.氯气通入水中,溶液呈酸性:Cl2+H2O  2H++Cl-+ClO- 2H++Cl-+ClO- |
| B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ |
| C.向明矾溶液中滴加Ba(OH)2溶液,达沉淀物质的量最大:2Al3++3SO42-+3Ba2++6OH-=" 2" Al(OH)3↓+3BaSO4↓ |
| D.过量铁溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O |


科目:高中化学 来源:不详 题型:单选题
| A.c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- |
| B.水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- |
| C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- |
| D.能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
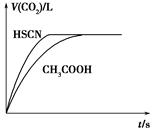

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+,K+,SO42-,I- | B.Mg2+,NH4+,NO3-,Cl- |
| C.Na+,K+,SO42-,Al(OH)4一 | D.Ba2+,Na+,NO3-,CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32— NO3— SO42— I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl- |
| C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32- |
| D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、S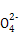 |
B.b点对应的溶液中大量存在:N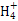 、Ba2+、OH-、I- 、Ba2+、OH-、I- |
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HC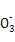 |
D.d点对应的溶液中大量存在:Na+、K+、S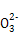 、Cl- 、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 随着温度的升高而增大,说明水的电离是放热反应
随着温度的升高而增大,说明水的电离是放热反应 增大
增大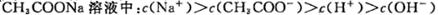
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com