
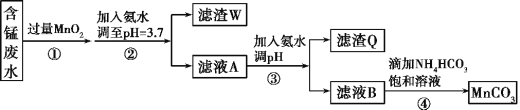
【题目】MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3:
已知:几种金属离子沉淀的pH如下表。
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)①中加入过量MnO2的作用是___,滤渣W的成分是___。
(2)过程③中,调pH的目的是___。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是___。
(4)过程④中得到纯净MnCO3的操作方法是___,该过程中副产品的化学式是___。
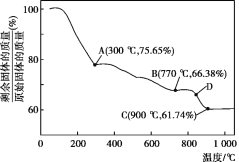
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。
【答案】将Fe2+氧化为Fe3+ Fe(OH)3和MnO2 使Cu2+完全沉淀为Cu(OH)2 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 过滤、洗涤、干燥 NH4Cl 1∶2 Mn3O4和MnO
【解析】
⑴在过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,过量的MnO2也以固体形式存在,通过调节溶液pH值将铁离子沉淀。
⑵过程③中,调pH是将Cu2+转化为沉淀除去。
⑶过程④中主要是Mn2+与HCO3-反应生成CO2和碳酸锰。
⑷过程④中得到纯净MnCO3的操作方法是过滤、洗涤、干燥,根据离子守恒因此得到还有副产物。
⑸根据分解后得到的产物质量进行计算。
⑴在过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,在过程②中,向溶液中加入氨水,调节溶液的pH=3.7,这时溶液中的Fe3+会形成Fe(OH)3沉淀,过量的MnO2也以固体形式存在,故答案为:将Fe2+氧化为Fe3+;Fe(OH)3和MnO2。
⑵过程③中,调pH是将Cu2+转化为沉淀除去,故答案为:使Cu2+完全沉淀为Cu(OH)2。
⑶过程④中,反应会有CO2生成,故反应的离子方程式为Mn2++2HCO3-=MnCO3↓ + CO2↑ +H2O,故答案为:Mn2++2HCO3-=MnCO3↓ + CO2↑ +H2O。
⑷过程④中得到纯净MnCO3的操作方法是过滤、洗涤、干燥,实验流程中,氯离子未除去,加入铵根离子,则副产品为NH4Cl,故答案为:过滤、洗涤、干燥;NH4Cl。
⑸设MnCO3的物质的量为1mol,则其质量为115g,A点剩余固体质量为115g×75.65% ≈ 87g,减少的质量为115g-87g=28g,可知MnCO3失去的组成为CO,故剩余固体的成分为MnO2,n(Mn)∶n(O)为1∶2。C点剩余固体质量为115g×61.74%≈71g,根据锰元素守恒知m(Mn)=55g,则m(O)=71g-55g=16g,则n(Mn)∶n(O)=![]() ∶
∶![]() =1∶1,故剩余固体的成分为MnO;同理可求出B点剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。
=1∶1,故剩余固体的成分为MnO;同理可求出B点剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于氯化钠晶胞(如图)的说法正确的是( )
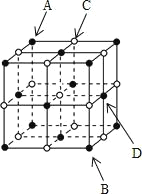
A.每个晶胞含有6个Na+和6个Cl-
B.晶体中每个Na+周围有8个Cl-,每个Cl-周围有8个Na+
C.晶体中与每个Na+最近的Na+有8个
D.将晶胞沿体对角线AB作投影,CD两原子的投影将相互重合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成 ![]() (部分试剂和反应条件已去).
(部分试剂和反应条件已去).

请回答下列问题:
(1)A的名称为__________。
(2)分别写出 B、F 的结构简式:B_____、F_____。
(3)反应①~⑦中属于消去反应的是_____,属于加成反应的是_____(填代号)。
(4)根据反应![]() +Br2
+Br2![]() ,写出在同样条件下CH2=CH—CH=CH2 与等物质的量Br2反应的化学方程式:__________________。
,写出在同样条件下CH2=CH—CH=CH2 与等物质的量Br2反应的化学方程式:__________________。
(5)写出第④步的化学方程式_______________。
(6)下列有机物分子中,在核磁共振氢谱图中能给出三种峰(信号)且强度之比为 1∶1∶2 的是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在![]() 过量的情况下,溶液中仍含有________(填离子符号)。
过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
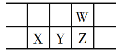
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
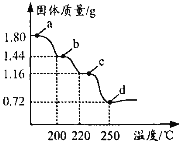
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G、W、X、Y、Z均为含氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G![]() W+NaCl ②W+H2O
W+NaCl ②W+H2O![]() X+H2 ③Y+NaOH
X+H2 ③Y+NaOH![]() G+W+H2O ④Z+NaOH
G+W+H2O ④Z+NaOH![]() W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
A.W、G、Z、Y、XB.G、Y、W、Z、X
C.G、Y、Z、W、XD.Z、X、G、Y、W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__(填“正”或“负”)极,已知CH4发生反应的电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则另一极的电极反应式为___。
(2)利用上述燃料电池,按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
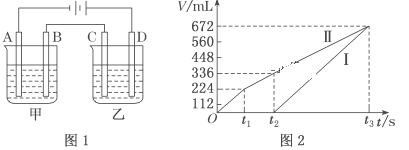
Ⅰ.甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为___,CuSO4的物质的量浓度为__。
②t2时所得溶液的pH=__。
Ⅱ.乙槽为200mLCuSO4溶液,乙槽内电解的总离子方程式:___;
①当C极析出0.64g物质时,乙槽溶液中生成的H2SO4为__mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入__(填字母)。
A.Cu(OH)2 B.CuO
C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙槽溶液中加入0.2mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com