
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
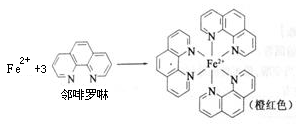
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:4FeCl3+2NH2OH·HCl=4FeCl2+N2O+6HCl+H2O
①Fe3+在基态时,核外电子排布式 。
 ②羟胺(NH2OH)中O采用 杂化。
②羟胺(NH2OH)中O采用 杂化。
③Fe2+与邻啡罗啉形成的配合物中,配体数为 。
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的晶体[Cu(NH3)4]SO4·H2O,该晶体中含有的化学键类型是 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
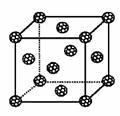
(4)现把C60抽象成质点,该晶体的晶胞结构如右图所示,如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。若C60的半径为apm,则掺杂C60化合物密度为 g/cm3。(阿伏加德罗常数用NA表示)
(1)①ls22s22p63s23p63d5或[Ar]3d5 ②sp3 ③3 -------------------------------每项2分
(2)离子键 共价键(配位键)------------------------------------------------------------------------------------2分
(3)NH3 中的N呈-3价,易提供孤对电子,Cu2+ 提供空轨道形成配位键,而NF3 中的N呈+3价,故N的原子核对其孤对电子的吸引力增强,难以提供孤对电子与Cu2+ 形成配位键---------------------------2分
(4)K 2C60---------------------------2分 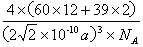 ---------------------------3分
---------------------------3分


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布图为 ;
(2)把HCl气体、NaCl固体、蔗糖分别溶于水,其中化学键发生变化的是 ;
(3)常温下把HCl气体溶于水制得0.1mol/L盐酸,该溶液中由水电离出的氢离子浓度为
mol/L;
(4)常温下把FeCl3固体溶于水,溶液的pH 7(填“大于”“小于”或“等于”),用离子方程式解释原因: ;把该溶液蒸干并灼烧,所得物质的化学式为 ;
(5)水既有氧化性又有还原性,请写出一个表现水的氧化性的化学方程式:
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,此配合离子的化学式是 ;向该蓝色溶液中加入少量氨水,现象为 ,继续加入过量氨水会产生 现象,原因
是 (用化学方程式或离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,主要反应属于消去反应的是( )
A.乙醇与NaBr,浓H2SO4共热 B.乙醇与浓H2SO4、乙酸共热
C.乙醇与浓H2SO4共热至140℃ D.乙醇与浓H2SO4共热至170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A常用作烟道气的警告剂,也可以做橡胶硫化促进剂、鞣剂等。一定条件下它可发生下图转化。已知E为高分子化合物。
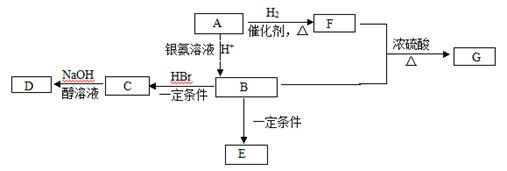
(1) 7.0 g有机物A完全燃烧可产生0.4 mol CO2和5.4 g H2O,经测定A分子含有甲基,所有的碳原子在一条碳链上,其蒸气对氢气的相对密度是35,A的结构简式为 。
(2)F中所含官能团的名称是 ,具有此官能团的F的同分异构体的数目有 种。
(3)B→C的反应类型为 ,C→D的反应类型为 。
(4)写出F+B→G的化学方程式 。
(5)下列关于B的说法正确的是 (填字母)。
A.不能使酸性高锰酸钾溶液褪色
B.可以与金属钠生成氢气
C.可以与碳酸钠反应
D.所有的原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.汽油燃烧产生的尾气中,含有碳的氧化物、氮的氧化物等污染物
B.我国许多城市已经推广使用清洁燃料,如压缩天然气(CNG)类、液化石油气(LPG)类,这两类燃料的主要成分都是烃类。
C.光束通过下列分散系①有尘埃的空气②Fe(OH)3胶体③墨水④稀豆浆时,都能产生丁达尔效应
D.114号元素在周期表中第七周期第VIA族,属于金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成 +2价?写出有关反应的化学方程式或离子方程式。
+2价?写出有关反应的化学方程式或离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
A.2Fe3++Fe===3Fe2+成立说明氧化性:Fe3+>Fe 2+
2+
B.25 ℃,pH=0的溶液中,Al3+、NH 、NO
、NO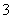 、Fe2+可以大量共存
、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用正确的是
A.石英坩埚耐高温,可用来加热熔化NaOH固体
B.浓硫酸有脱水性,可用作干燥剂
C.二氧化硫有漂白性,可大量用于加工食品使食品漂白
D.医用酒精能使蛋白质变性,可用来消毒杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com