
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 次氯酸的分解反应 | D. | 甲烷的分解反应 |
分析 A、光照条件下,氯气与氢气发生化合反应;
B、光照条件下,氯气与甲烷发生取代反应;
C、光照条件下,次氯酸易分解;
D、甲烷与氧气在点燃的条件下反应,光照条件下不反应.
解答 解:A.氯气可在光照或点燃条件下发生化合反应生成氯化氢,故A错误;
B.光照条件下,氯气与甲烷发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳等有机物和氯化氢,故B错误;
C.次氯酸不稳定性,在光照条件下发生:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2,故C错误;
D.甲烷与氧气在点燃的条件下反应,光照条件下不发生分解反应,故D正确.
故选D.
点评 本题考查常见物质的性质,题目难度不大,注意在光照条件下能发生反应的物质,注重常见相关物质的性质等知识的积累.


科目:高中化学 来源: 题型:解答题
 某同学通过如下实验,探究化学反应中的能量变化.
某同学通过如下实验,探究化学反应中的能量变化. ,用湿润的红色石蕊试纸检验该气体.
,用湿润的红色石蕊试纸检验该气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
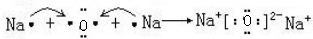 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | W | Q | M | R | X | Y |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 原子半径:Y<M<Q,所以原子序数:Y>M>Q | |
| B. | M、Q、W都是金属,且其单质与盐酸反应的速率:M>Q>W | |
| C. | Q2+与X2-的电子层结构相同,且X2-离子半径大于Q2+ | |
| D. | M的氧化物能与W的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+Fe3+ Cl-NO3- (1:1:3:1) | |
| B. | Ca2+ K+ OH- HCO3- (1:1:2:1) | |
| C. | H+ SO42- OH- Ba2+ (2:1:2:1) | |
| D. | Na+ PO43- H+ SO42- (2:1:3:1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积0.1mol/LHCl和0.1mol/LH2SO4分别与等体积0.2mol/L NaOH溶液反应 | |
| B. | 等质量锌粒和锌粉分别与等体积1mol/L HCl反应 | |
| C. | 等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应 | |
| D. | 等体积0.2mol/LHCl和0.1mol/LH2SO4与等量等表面积等品质的石灰石反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: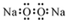 | B. | 中子数为 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫离子的结构示意图: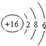 | D. | HCN的结构式:H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com