
【题目】密度为0.910 g·cm-3的氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,

理由:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
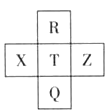
A. T的单质在化学反应中只表现氧化性
B. R与Q的电子数相差16
C. T形成的含氧酸的酸性一定比X形成的含氧酸强
D. 在这五种元素中Z的化学性质最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
②W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于 晶体(填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图4,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= pm。(用含ρ、NA的计算式表示)
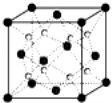
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 标准状况下,等体积的CH4和CO2分子数相等
B. 与NaOH溶液、稀硫酸反应产生等量的H2,所需铝粉的质量相等
C. 常温下,铜与浓硫酸迅速反应产生SO2气体
D. 1mol OH- 和17g NH3所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种方法,某有机物12g在氧气中完全燃烧,生成7.2g水和8.96LCO2(标况)。0.5mol该有机物的质量为30g。
(1)试求该有机物分子式_________________________;
(2)若该有机物能与Na2CO3溶液反应产生气体,则其结构简式为________________;
若该有机物既能与Na反应产生气体,又能发生银镜反应,则结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铁水解的离子方程式为 ,其溶液中离子浓度大小顺序为 。现向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其反应的离子方程式为: 。同时有红褐色沉淀生成,其原因是 。
(2)水玻璃在工业上可作粘合剂,它与NH4Cl溶液接触时,会很快凝结,用离子方程式表示其原因为 。
(3)下列各物质的溶液物质的量浓度均为0.1mol/L:①HCl ②NaOH ③Na2CO3 ④CH3COONa ⑤NH4Cl ⑥H2SO4 ⑦KCl ⑧CH3COOH ,它们 pH 由小到大的排列顺序为: 。
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
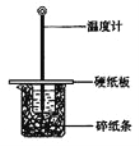
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热△H_____ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会 (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________(填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
实验用品[ | 溶液温度 | 中和热 △H | |||
起始平 均温度 | 反应最高温度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________(保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
A.实验装置保温、隔热效果差
B.量取稀盐酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定的说法正确的是
A. 强酸滴定弱碱时可用酚酞作指示剂
B. 滴定时向待测液中滴入标准液的速率应先快后慢
C. 滴定过程中,眼睛应始终注视着滴定管的刻度线
D. 若操作无失误,只需滴定—次即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com