
常温下,实验室有0.01mol?L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol?L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol?L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
BD
解析试题分析:醋酸是弱酸,部分电离出氢离子,则溶液中氢离子浓度远小于醋酸浓度,即c(H+)<0.01mol?L-1,醋酸溶液呈电中性,根据电荷守恒原理可得:c (CH3COO-) + c (OH-)= c(H+)<0.01mol?L-1,故A选项错误;pH=12,则氨水中c (OH-)=Kw/c(H+)=0.01mol?L-1,一水合氨是弱碱,少部分电离出氢氧根离子,则一水合氨浓度远大于0.01mol?L-1,因此等体积混合时氨水过量,醋酸不足,混合后溶液呈碱性,故B选项正确;醋酸钠是易溶于水的强电解质,加入醋酸钠固体,增大醋酸根离子浓度,使醋酸的电离平衡左移,醋酸电离程度减小,虽然醋酸电离出的醋酸根离子减少,但是溶液中醋酸根离子浓度明显增大,故C选项错误;硝酸钠是强电解质,硝酸根离子与硝酸钠的物质的量相等,醋酸是弱酸,存在电离平衡,根据物料守恒原理可知,醋酸和醋酸根离子与硝酸钠的物质的量相等,则溶液中c (NO3-) =" c" (CH3COO-)+c (CH3COOH),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及酸与盐溶液中电荷守恒关系式、溶液pH、水的离子积、电离平衡移动、溶液的酸碱性、盐与盐溶液中物料守恒关系式等。


科目:高中化学 来源: 题型:单选题
向20mL0.5mol L
L 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH-):b点>a点 |
| C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢按溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO- 3+OH-=CO2- 3+H2O |
| B.25℃时,pH=8的0.lmol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol·L-1 |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液中,c(NH+ 4)前者小于后者 |
| D.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH+ 4)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于常温下0.0lmol/L的氨水,下列叙述正确的是
| A.c(H+)+c(NH4+)=c(OH-) |
| B.与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3· H2O)="0.02" mol·L-1 |
| C.与等体积等浓度的盐酸混合后所得溶液显酸性 |
| D.由H2O电离出的c(H+)=1.0×10-12 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于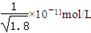 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
| A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-) |
| D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知HF酸性强于CH3COOH,常温下有下列三种溶液。有关叙述不正确的是
| A.②、③混合后:C(H+)=C(F-)+C(CH3COO-)+ c(OH-) |
| B.①、②等体积混合后:c(CH3COO-)>c(Na+)>C(H+)>c(OH-) |
| C.中和相同体积的②、③,需消耗相同体积的① |
| D.向②加入NaF固体,CH3C00H电离平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com