
| A. | 它与水反应的离子方程式为NH4++H-+H2O=NH3•H2O+H2↑ | |
| B. | NH5中既有共价键又有离子键 | |
| C. | NH5的电子式为 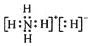 | |
| D. | 1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
分析 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,应为NH4H,是一种离子化合物,能与水反应:NH4H+H2O=NH3•H2O+H2↑,有氨气生成,据此分析.
解答 解:A.能与水发生NH4H+H2O=NH3•H2O+H2↑,离子方程式为NH4++H-+H2O═NH3•H2O+H2↑,故A正确;
B.NH4H是一种离子化合物,含离子键和N-H共价键,故B正确;
C.NH5应为NH4H,是离子化合物,其电子式为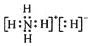 ,故C正确;
,故C正确;
D.NH5是离子化合物氢化铵,铵根中的氮原子与四个氢原子形成四个共价键,NH4+与H-之间为离子键,1 mol NH5中含有4 NA个N-H键,故D错误;
故选D.
点评 本题考查化学键,把握铵盐的结构及化学键判断为解答的关键,侧重分析与应用能力的考查,注意阴离子是H-为解答的难点,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:选择题
| A. | 裂化汽油不能萃取溴水中的溴 | |
| B. | 石油的分馏以及煤的气化和液化是物理变化 | |
| C. | 煤中含有大量的苯等芳香烃,煤是芳香烃的主要来源 | |
| D. | 煤属于有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
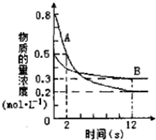 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )| A. | 前12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | 12s后,A的消耗速率等于B的生成速率 | |
| C. | 化学计量数之比b:c=1:2 | |
| D. | 12s内,A和B反应放出的热量为0.2Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
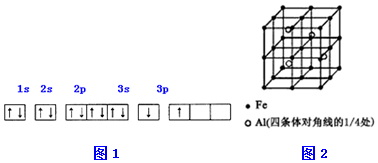
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 70%-75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得乙酸、苯及甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
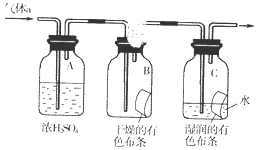 氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.
氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com