
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( ) 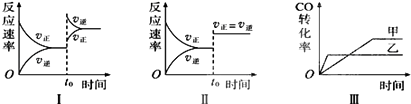
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
【答案】C
【解析】解:A.图Ⅰ正逆反应速率均增大,且逆反应速率大于正反应速率,该反应为放热反应,则改变的条件为升温,故A正确;
B.图Ⅱ中正逆反应速率同等程度的增大,该反应为体积不变的反应,则改变的条件为增大压强(缩小体积)或使用催化剂,故B正确;
C.图Ⅲ中乙先达到平衡状态,但甲、乙的转化率不同,不是催化剂的原因,应为乙的温度高,故C错误;
D.图Ⅲ中乙先达到平衡状态,且乙中CO的转化率小,该反应为放热反应,则乙的温度高,故D正确;
故选C.
A.图Ⅰ正逆反应速率均增大,且逆反应速率大于正反应速率;
B.图Ⅱ中正逆反应速率同等程度的增大;
C.图Ⅲ中乙先达到平衡状态;
D.图Ⅲ中乙先达到平衡状态,且乙中CO的转化率小.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( ) 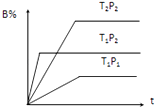
A.T1<T2、P1>P2、m+n>p,△H<0
B.T1>T2、P1<P2、m+n>p,△H>0
C.T1>T2、P1<P2、m+n<p,△H>0
D.T1<T2、P1>P2、m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物)为原料制备MgCO33H2O.实验过程如图1 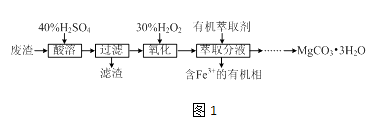
(1)酸溶需加热的目的是;过滤时用到的玻璃仪器有
(2)加入H2O2氧化时发生发应的离子方程式为 .
(3)用如图2所示的实验装置进行萃取和分液,以除去溶液中的Fe3+ . 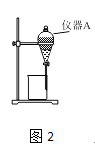
①实验装置图2中仪器A的名称为 .
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有溶液的仪器A中加入一定量的有机萃取剂,、静置、分液,并重复多次.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国古代四大发明之一,由硫磺、火硝和木炭粉均匀混合而成,点燃后可能发生的反应:S+2KNO3+3C=N2↑+3CO2↑+X(已配平),则物质X是
A. K2S B. SO2 C. H2S D. SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气遇氯气时,有白烟出现,发生的反应可能有
①2NH3+3Cl2=6HCl+N2 ②NH3+HCl= NH4Cl
下列说法正确的是
A. ①为化合反应 B. ②为置换反应 C. ①为氧化还原反应 D. ②为复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气” 或“无法确定”)
(2)写出C装置中反应的化学方程式:_________
(3)若装置是不漏气的,打开止水夹a后,用上述装置进行实验。写出A中发生反应的化学方程式,并用双线桥标出化合价变化情况、电子转移的方向和数目及被氧化还原情况 _________
(4)B装置中盛放的试剂是__________,其作用是___________ D仪器名称是 _____
(5)Fe(OH)2 在潮湿空气中变成灰绿色、红褐色:_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
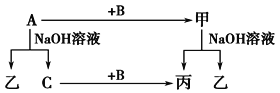
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铁铜合金中加入过量的硝酸溶液,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全.若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸.则反应中消耗的NaOH溶液的体积是( )
A.150ml
B.180ml
C.200ml
D.250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由石英砂和焦炭在高温下制备粗硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种气体,写出配平的化学反应方程式: _____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是______________。
(2)下列有关硅材料的说法正确的是_____________ (填字母代号)。
A.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
B.石英坩埚耐高温性强,可用于加热熔融氢氧化钠
C.神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制作电脑芯片
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故可采用盐酸为抛光液抛光单晶硅
F.玛瑙饰品的主要成分与建筑材料砂子相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com