
已知:C(s)+H20(g)=CO(g)+H2(g) △H=akJ·mol—1;2C(s)+02(g)=2CO(g) △H=一220kJ·mol—1;H—H、O=0和O—H键的键能分别为436、496和462kJ·mol—1,则a为 ( )
A.—332 B.+130 C.+332 D.—l30
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
在一个盛有催化剂的容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2(g)+3H2(g) 2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸、稀H2SO4 | B. | KCl、BaCl2、CuSO4 | ||
| C. | KCl、BaCl2、CaCl2 | D. | FeCl3、Fe2(SO4)3、NaCl | ||
| E. | FeCl3、Fe2(SO4)3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- | |
| D. | $\frac{c{(H}^{+})}{c({OH}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
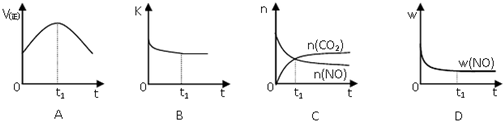
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的物质的量 | B. | 气体分子之间的平均距离 | ||
| C. | 气体分子本身的大小 | D. | 气体的种类A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO${\;}_{3}^{2-}$+2H+═H2O+CO2↑ | |
| D. | NaOH溶液与NaHSO4溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b且pH(NaX)>pH(NaY),则酸性HX<HY | |
| B. | 若a=b且c(X -)=c(Y -)+c(HY),则酸性HX>HY | |
| C. | 若a>b且c(X -)=c(Y -),则酸性HX<HY | |
| D. | 若a=0.1mol/L且两溶液等体积混合,则c(X -)+c(HX)=0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com