
已知胆矾溶于水时溶液温 度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s)
度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s) CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为()
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为()
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
考点: 用盖斯定律进行有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 胆矾溶于水时可分为两步,一是胆矾分解成无水硫酸铜,二是无水硫酸铜溶解,然后结合盖斯定律来解答.
解答: 解:胆矾溶于水时溶液温度降低,可知其为吸热过程,△H>0,
1mol胆矾分解生成1molCuSO4(s)时,CuSO4•5H2O(s) CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1
1molCuSO4(s)溶解时放热Q2 kJ
可得如下图所示关系,
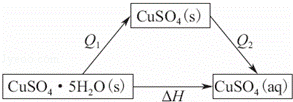
根据盖斯定律,则有△H=Q1+(﹣Q2)>0,则Q1>Q2,
故选A.
点评: 解答此类习题的关键是,读懂题意,正确列出图示关系.
该题出的不是很好
盖斯定律是说化学反应,而硫酸铜溶解在中学认为是纯粹的物理变化.


科目:高中化学 来源: 题型:
一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,下列关于此燃料电池的有关说法中错误的是()
A. 通过甲烷的电极X为电池的负极,通过氧气的电极Y为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上合成氨气,已知通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%(已知:N2的转化率=实际反应的N2的量/初始充入N2的总量),则合成氨气的热化学方程式可表示为()
A. N2(g)+3H2(g)⇌2NH3 (g)△H=a kJ/mol
B. N2(g)+3H2(g)⇌2NH3 (g)△H=﹣a kJ/mol
C. N2(g)+3H2(g)⇌2NH3 (g)△H=5a kJ/mol
D. N2(g)+3H2(g)⇌2NH3(g)△H=﹣5a kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是()
A. Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=﹣216 kJ/mol,则反应物总能量大于生成物总能量
B. 若一定条件下,A═B△H<0,说明A物质比B物质稳定
C. 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,则H2的燃烧热为571.6 kJ/mol
D. H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,含1 molNaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)⇌2Z(g),一定达到化学平衡状态的是()
①X、Y、Z的物质的量之比为1:2:2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
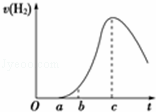
将在空气中久置的铝片与0.5mol•L﹣1硫酸反应,产生氢气的速率与反应时间可用如图所示的曲线表示,试回答下列问题.
(1)曲线O→a段不产生氢气的主要原因是(用有关化学方程式表示): .
(2)曲线b→c段产生氢气的速率增加较快的主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于平衡常数K的说法中,正确的是()
A. 在任何条件下,化学平衡常数是一个恒定值
B. 改变反应物浓度或生成物浓度都会改变平衡常数K
C. 平衡常数K只与温度有关,与反应浓度、压强无关
D. 从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是()
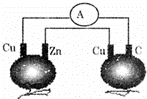
A. 锌片是负极 B. 两个铜片上都发生氧化反应
C. 石墨是阴极 D. 两个番茄都形成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为
________,原因是_________________________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换
树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入
__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水
的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰
性电极。请分析下列问题:
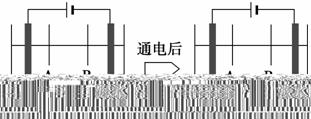
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com