
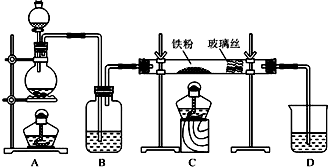
分析 (1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,浓硫酸可以干燥氯气;D中为尾气吸收装置,可用氢氧化钠溶液吸收氯气;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,据此解答即可;
(3)若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,据此解答即可.
解答 解:(1)制取无水氯化铁的实验中,A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B的作用是干燥氯气,常用浓硫酸;
氯气有毒,需要用强碱溶液吸收,所以D中发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓硫酸;Cl2+2OH-=Cl-+ClO-+H2O;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2,故尾气的成分为未反应的HCl和生成的氢气,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且氢气不溶于水,不利于氢气的吸收,氢气易燃,造成安全隐患,
故答案为:HCl;HCl和H2;发生倒吸;可燃性气体H2不能被吸收;
(3)若要制取纯净的FeCl2,需先排净装置中的空气,故先点燃A处的酒精灯,再点燃C处的酒精灯,
故答案为:点燃A处的酒精灯;点燃C处的酒精灯.
点评 本题考查了制备方案的设计,题目难度中等,设计实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等知识,明确实验目的为解答关键,注意掌握制备方案的设计方法,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | C的简单离子还原性大于D | |
| B. | D元素只能以化合态存在于自然界中 | |
| C. | A元素所形成离子的半径有可能大于He原子的半径 | |
| D. | B、D的原子不能相互结合形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:
元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.
常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
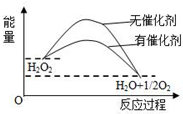
| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com