
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+5/2O2(g)—→2CO2(g)+H2O(l) ΔH=-1 300 kJ/mol
②C6H6(g)+15/2O2(g)—→6CO2(g)+3H2O(l) ΔH=-3 295 kJ/mol
下列说法正确的是( )
A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列物质的分类合理的是( )
A.酸:HNO3、H2SO4、NaHSO4、NaHCO3
B.碱性氧化物:K2O、Na2O、CaO、MgO
C.胶体:牛奶、豆浆、碘酒、石灰水
D.电解质:MgCl2、Na2CO3、C2H5OH、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含有碘元素,碘缺乏者宜多食海带,为检测海带中是否含有碘元素,实验人员将海带在坩埚中烧成灰渣后加水搅拌,使海带中的碘离子溶于水,然后在所得澄清溶液中通入氯气,将碘离子转变成单质碘,为进一步检验溶液中单质碘的存在,人们利用碘易溶于四氯化碳溶剂且呈紫色的特殊性进行确认,最终发现海带中含碘。
(1)在上述实验中提到的两步常见分离操作的名称是:__________、__________。
(2)用于物质分离的这两种方法需要的玻璃仪器分别是______________________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.化学变化过程是原子的重新组合过程
B.根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应
C.化学反应中的能量变化多少与其反应物用量有关
D.化学反应中的能量变化都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
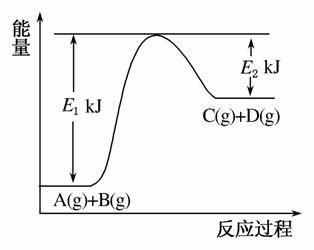
)已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.铜的化学性质活泼,不宜用铜制作盛食品的器皿
B.盛放NaOH溶液的玻璃试剂瓶不能用玻璃塞
C.只用KSCN溶液就可检验FeCl3溶液中的少量Fe2+
D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式__________________________________。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是______________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?__________________________________ __________________________________。
(3)合成氨工业中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为12时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:2Fe2O3+C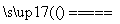 4FeO+CO2↑。
4FeO+CO2↑。
实验教师提供了12 g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023mol—1,下列叙述中正确的是( )
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L苯所含的分子数约为6.02×1023
D.标准状况下,a L乙烷气体中的所含共价键数约为(a/22.4)×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com