
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是

A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应是利用其溶解度小于NaCl
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
A.0.3 mol NO、0.1 mol NO2
B.0.3 mol NO2、0.1 mol NO
C.0.6 mol NO
D.0.3 mol NO2
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷(解析版) 题型:选择题
已知:在101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是

A.非金属性:Z<T<X
B.最高价氧化物的水化物的酸性:Q>T
C.气态氢化物稳定性:R<T<Q
D.R与Q的电子数相差26
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是:①过量的锌与18 mol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应
A.②③⑤ B.②③④⑥
C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
下列除去杂质的方法正确的是
A.Cl2中混有少量HCl:通过盛有硝酸银溶液的洗气瓶
B.Cl2中混有少量水蒸气:通过足量浓硫酸,收集气体
C.Cl2中混有少量HCl:通过碱石灰后收集气体
D.HCl中混有少量Cl2:通入氢气光照
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:填空题
(普通班)(13分)(1)常温下, CH3COONa溶液呈 性,用离子方程式解释其原因 。
(2)室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
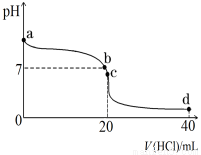
①NH3·H2O的电离方程式是 。
②b点所示溶液中的溶质是 。
③c点所示溶液中,离子浓度从大到小的关系为 ,在该溶液中存在多种守恒关系,其中c(NH4+)+c(H+)= (用离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:填空题
用18.4mol/L的浓H2SO4配制100mL 0.50mol/L的稀H2SO4,请按要求填空( 每 空 1分,共 计 10分)
(1)用量筒量取所需浓H2SO4的体积为 mL;
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒,实验中还需要用到的仪器有 、 、烧杯、玻璃棒。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容
②定容时俯视刻度线
③容量瓶洗净后未干燥 ;
④摇匀后发现液面低于刻度线后加水至溶液的凹液面与刻度线相平 ;
⑤用量筒量取浓H2SO4时仰视刻度线: 。
(4)若定容时液面高于刻度线应采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014~2015年河北省高一第一学期第一次月考化学试卷(解析版) 题型:选择题
下列电离方程式中正确的是( )
A.H2SO4=H2++SO42- B.Ca(OH)2=Ca2++(OH)2-
C.AlCl3=Al+3+3Cl-1 D.Fe2(SO4)3=2Fe3++3SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com