
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT = 2.520 mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
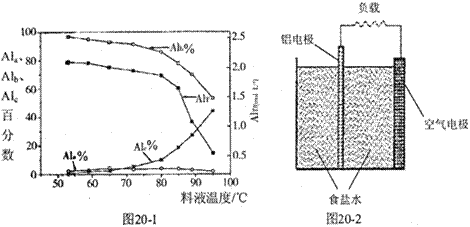
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是 。
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 = a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2 = b kJ·mol-1
则反应Al2O3(s)+ 3C(s) = 2Al(l)+ +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式 。
【答案】(1)13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①减小;②Al3++3H2O=Al(OH)3(胶体)+3H+;
③温度升高,水解程度加大,产生氢氧化铝沉淀;(3)a+b;>;(4)O2+2H2O+4e-=4OH-。
【解析】
试题分析:(1)根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①在一定温度下,AlT越大,Ala%越大,Alc%越小,所以pH减小;②如将AlT = 2.520 mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:Al3++3H2O=Al(OH)3(胶体)+3H+;③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图所示。当T>80℃时,AlT显著下降的原因是温度升高,水解程度加大,产生氢氧化铝沉淀;(3)①+②整理可得Al2O3(s)+ 3C(s) = 2Al(l)+ +3CO(g) △H =△H1+△H2 =-(a+b)kJ/mol;反应①常压下在1900℃的高温下才能进行,说明该反应是吸热反应,△H>0;(4)在该铝空气电池中活动性强的Al作负极,活动性弱的C作正极。由于是在中性介质中,所以发生的是吸氧腐蚀。该电池正极的电极反应式是O2+2H2O+4e-=4OH-。
考点:考查物质的存在形式与溶液酸碱性的关系、离子方程式的书写、反应的热效应的判断、原电池反应原理的知识。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
有机物X的结构如下,下列说法正确的是
A. X能发生氧化、取代、酯化、加聚、缩聚反应
B. X与FeCl3溶液不能发生显色反应
C. 1mol X与足量NaOH溶液反应,最多消耗2mol NaOH
D. X的分子式为C23H26 N2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况) B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示 对应的装置合理、操作规范的是
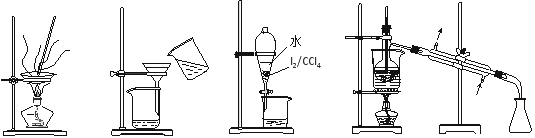
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
葛根素具有降血压等作用,其结构简式如下图,下列有关说法正确的是
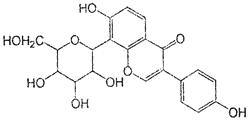
A.该物质在一定条件下能发生消去反应、加成反应、取代反应
B.葛根素的分子式为C21H22O9
C.该物质一个分子中含有5个手性碳原子
D.一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出
B.向FeSO4溶液中通入过量CO2,有浑浊现象产生
C.SO2具有漂白性,常用于自来水消毒
D.Fe和Br2混合加热生成FeBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)斜长石(KAlSi3O8)和NaCl熔浸可制得KCl,原理是:
NaCl(l) + KAlSi3O8(s) KCl(l)+ NaAlSi3O8(s)。
KCl(l)+ NaAlSi3O8(s)。
①. 斜长石含有的化学键类型有_________________。
②. 上述反应涉及的元素原子中,半径最大的是 ,它和氢元素形成的化合物的电子式为 __________。
(2)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓由
大到小的顺序为 。
(3)亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
①.往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式:
。
② .碲酸(H6TeO6)氧化性比浓硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: HI+ H6TeO6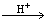 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
已知Cu(OH)2 能溶解在足量的氨水中,则其离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol﹣1
②N2(g)+3H2(g)⇌2NH3(g)△H2=﹣92.4kJ•mol﹣1
③2H2(g)+O2(g)═2H2O(g)△H3=﹣483.6kJ•mol﹣1
下列说法正确的是( )
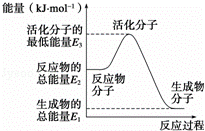
|
| A. | 反应②中的能量变化如图所示,则△H2=E1﹣E3 |
|
| B. | H2的燃烧热为241.8 kJ•mol﹣1 |
|
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
|
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com