
| A. | OH-、H2O、F- | B. | H3O+、NH4+、Cl- | C. | HF、Ne、H2O | D. | NH3、NH4+、F- |
分析 根据原子的质子数相加即为微粒的质子数,阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数来分析解答.
解答 解:A、OH-、H2O、F-的质子数分别为9、10、9,电子数分别为10、10、10,故A错误;
B、H3O+、NH4+、Cl-的质子数分别为11,11、17,电子数分别为10,10、18,故B错误;
C、HF、Ne、H2O的质子数都是10,电子数都是10,故C正确;
D、NH3、NH4+、F-的质子数都是10、11、9,电子数都是10,故D错误;
故选C.
点评 本题考查微粒的质子数和电子数,明确质子数和电子数的计算及中性微粒中质子数等于电子数是解答本题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)n+1也为强碱 | |
| B. | 若最高氧化物的水化物HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
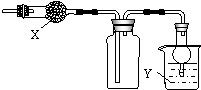 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠溶液 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com