
分析 ①酸雨中二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,被氧气氧化为硫酸;煤中加入适量石灰石,煤燃烧产生的二氧化硫会与碳酸钙分解生成的氧化钙反应生成亚硫酸钙,亚硫酸钙不稳定,被氧气氧化为硫酸钙,即为碳酸钙与氧气、二氧化硫反应生成硫酸钙与二氧化碳;
②汽车生产的有害气体为NO、CO,通过催化剂转化为无害气体,反应应生成氮气与二氧化碳;
③ClO2具有强氧化性,能将病毒氧化而杀菌消毒;铝离子水解生成氢氧化铝胶体,胶体具有吸附性而净水,据此分析解答.
解答 解:①酸雨pH<5.6中二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,被氧气氧化为硫酸;煤中加入适量石灰石,煤燃烧产生的二氧化硫与碳酸钙、氧气、二氧化硫反应生成硫酸钙与二氧化碳,反应方程式为2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2.
故答案为:5.6;H2SO4;石灰石;2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2;
②汽车生产的有害气体为NO、CO,通过催化剂转化为无害气体,反应应生成氮气与二氧化碳,反应方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
③ClO2具有强氧化性,病毒属于蛋白质,强氧化剂ClO2能将病毒氧化而使病毒变性,从而杀菌消毒;
铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中悬浮物而净水,水解方程式为A13++3H2O?Al(OH)3(胶体)+3H+,
故答案为:杀菌消毒;A13++3H2O?Al(OH)3(胶体)+3H+.
点评 本题考查环境污染与防治、二氧化硫性质等知识,题目难度不大,明确氮的氧化物、硫的氧化物的性质及应用,明确酸雨的成因及治理方法为解答关键,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO- | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 含有Fe3+的溶液中:Na+、Al3+、Cl-、SCN- | |
| D. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2+Br2+2H2OH2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 | |
| B. | 既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 | |
| C. | 在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 | |
| D. | 在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
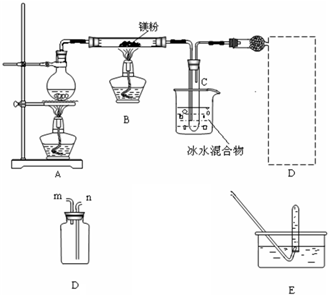
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| B. | N2是大气中的主要成分之一,雷雨时,可直接转化为NO2 | |
| C. | Cl2能与金属活动顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
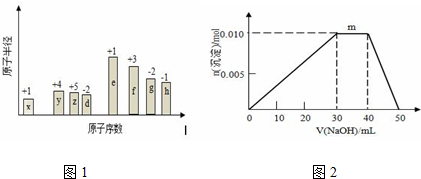
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com