
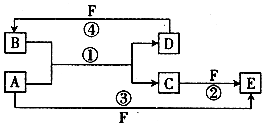
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) ,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.分析 (1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,A最外层电子数小于4且为偶数,D位于第二周期、A位于第三周期,则A是Mg、D是C元素;F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2,则F是HNO3,
C和HNO3浓溶液反应生成CO2、NO2和H2O,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2;
(2)若A是常见的金属的单质,D、F是气态单质,A是Fe,反应①在水溶液中进行.反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2;
(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,D为Si,F为O,B为SiO2,反应①为C与二氧化硅的反应.
解答 解:(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,A最外层电子数小于4且为偶数,D位于第二周期、A位于第三周期,则A是Mg、D是C元素,Mg的原子结构示意图为 ;F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2,则F是HNO3,C和HNO3浓溶液反应生成CO2、NO2和H2O,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2;通过以上分析知,B是CO2、F是HNO3,在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O,
;F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2,则F是HNO3,C和HNO3浓溶液反应生成CO2、NO2和H2O,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2;通过以上分析知,B是CO2、F是HNO3,在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O,
故答案为: ;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O;
;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O;
(2)若A是常见的金属的单质,D、F是气态单质,A是Fe,反应①在水溶液中进行.反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2,氯化亚铁被氯气氧化生成氯化铁,反应②(在水溶液中进行)的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+,常温下1g D与F反应生成B(气态)时放出92.3KJ热量,该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ•mol-1,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ•mol-1;
(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,D为Si,F为O,B为SiO2,反应①为C与二氧化硅的反应,该反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查无机物的推断、常用化学用语等,为高频考点,涉及常见元素及其化合物知识的考查,把握元素的位置及单质的性质来分析推断各物质,注意根据物质的特殊元素、物质结构、物质之间的转化关系进行推断,熟悉常见单质及其化合物的性质是解本题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应都有新物质生成 | |
| B. | 化学反应都伴随着能量的变化 | |
| C. | 化学反应都有电子的转移 | |
| D. | 化学反应的实质是旧化学键的断裂和新化学键的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12、2.5 | B. | 24、2.5 | C. | 12、3 | D. | 24、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 最高价含氧酸一定具有强氧化性 | |
| D. | 金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com