
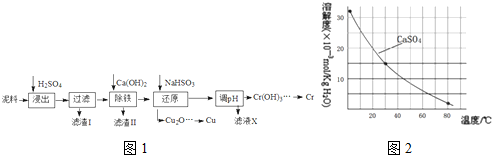
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |


科目:高中化学 来源: 题型:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH和Al2(SO4)3 |
| B、H2SO4和Na2CO3 |
| C、CaCl2和Na2CO3 |
| D、Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B、常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D、加热0.1mol?L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com