
在200℃时将11.6 g二氧化碳和水蒸气的混合气体通过足量的Na2O2,反应完全后,固体质量增加3.6 g.求混合气体的平均相对分子质量.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
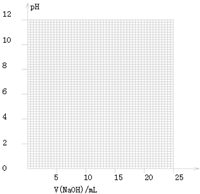
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若X为氧化物,X的化学式是 。?
(2)若X为单质,X用于焊接钢轨反应的化学方程式是。
(3)若X与稀硫酸反应生成无色没有气味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。?
X与稀硫酸反应的离子方程式是 。?
X与足量稀氢氧化钠溶液反应的离子方程式是 。?
①在宇航器中,可以不断地将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是 。?
②科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200~250 ℃时,镍催化作用下,生成甲烷和另一种物质。该反应的化学方程式是。
③熔融碳酸盐燃料电池的工作原理如图11所示:?
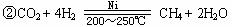
熔融碳酸盐燃料电池的工作原理示意图?
图11?
C(Ⅰ)的电极名称是 (填“正极”或“负极”)。该燃料电池的总反应化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com