
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O ,IO3-→I2, MnO4-→Mn2+ ,HNO3→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A. H2O2 B. IO3- C. MnO4- D. HNO3
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是( )
A. 通过足量的高锰酸钾溶液
B. 通入足量溴水中
C. 在导管中处点燃
D. 一定条件下与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于________(填字母,下同)。
a. 有机高分子材料 b. 无机非金属材料 c. 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是________。
a. 防治酸雨 b. 降低温室效应 c. 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是________。

a. 可以溶于盐酸
b. 相比纯金币,熔点高
c. 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和________。
②以上营养成分中________是人体中含有的微量元素。
③紫薯中的花青素能消耗活性氧,具有________性(选填“氧化”或“还原”),可用于抗衰老。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式__________________。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①下列措施中,不能减少雾霾的是________(填字母)。
a. 禁止焚烧秸秆、树叶
b. 优选公交出行,减少汽车尾气排放
c. 提倡火力发电,提高燃煤使用量
室内装修中使用不合格大理石可能会释放放射性气体________。
②下列污水处理的方法只涉及到物理变化的是________(填字母)。
a. 活性炭吸附法 b. 化学沉淀法 c. 中和法
废水处理时通常加入明矾作为混凝剂以吸附水中的杂质,明矾水解的离子方程式为_______________________。
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯的结构简式是________。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于________电池(选填“一次”或“二次”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A. 该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B. 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A—)>c(HA)>c(Na+)>c(H+)>c(OH—)
C. 0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中2c(H+)+ c(HA) = c(A—) + 2c(OH—)
D. 0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中c(A—) + c(HA) = c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】( 15 分)
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
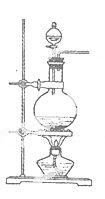
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3) = 2.8×10-9、Ksp(MnCO3) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。
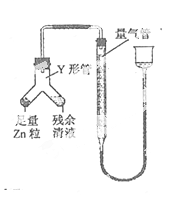
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.Ba2+、Cl-、NO3-、Ca2+ B.H+、Na+、SO42-、CO32-
C.Cu2+、K+、Cl--、OH- D.Ca2+、Na+、CO32、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com