
在强酸性溶液中,能大量共存的离子组是 ( )
A.NH4+ 、Na+ 、Cl-、SO42- B.Cu2+、Ca2+ 、CO32- 、Cl-
C.Al3+、 Ag+ 、NO3-、Cl- D.K+、HCO3-、Cl-、 Na+
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||


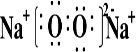
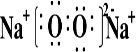

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
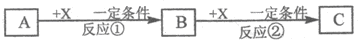
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是( )
A.H2 B.HCHO C.C12H22O11 D.维生素C
(2)Vc极不稳定,具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2====C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:取10 mL 6 mol·L-1 CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.20 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液。
①为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
②计算样品中维生素C的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com