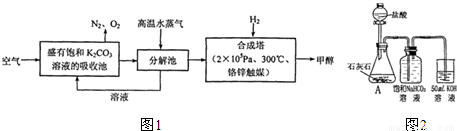
吸收或富集二氧化碳 2KHCO
3
K
2CO
3+CO
2↑+H
2O 碳酸氢钾或氢氧化钾 通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水 2:1 0.75
分析:I①碳酸钾能和二氧化碳反应生成碳酸氢钠;
②加热条件下,碳酸氢钾能分解;
II①当二氧化碳不足时,氢氧化钾剩余,当二氧化碳过量时生成碳酸氢钾;
②利用碳酸氢钾的不稳定性制取碳酸钾;
③比较1、2实验确定1中酸过量,根据质量和物质的量计算碳酸氢钾、碳酸钾的物质的量,从而确定其物质的量之比;
比较2、3实验知,3实验中酸量不足,再利用原子守恒计算硫酸的浓度.
解答:I①碳酸钾能和二氧化碳反应生成碳酸氢钠,所以碳酸钾的作用是吸收或富集二氧化碳,故答案为:吸收或富集二氧化碳;
②加热条件下,碳酸氢钾能分解生成碳酸钾、二氧化碳和水,反应方程式为:2KHCO
3
K
2CO
3+CO
2↑+H
2O,故答案为:2KHCO
3
K
2CO
3+CO
2↑+H
2O;
II①当二氧化碳不足时,氢氧化钾剩余,当二氧化碳过量时碳酸钾和二氧化碳、水反应生成碳酸氢钾,所以他所制得的溶液中可能含有的杂质是碳酸氢钾或氢氧化钾,故答案为:碳酸氢钾或氢氧化钾;
②利用碳酸氢钾的不稳定性制取碳酸钾,方法如下:通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水即得较纯净的碳酸钾溶液,故答案为:通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水;
③从实验2产生的CO
2比实验1多可知实验1中酸过量,碳酸钾与碳酸氢钾全部生成硫酸钾.
设3.76g混合物中含K
2CO
3为xmol,含KHCO
3为ymol,
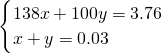
解得x=0.02,y=0.01;
所以碳酸钾和碳酸氢钾的物质的量之比=0.02mol:0.01mol=2:1,
从实验3产生的CO
2比实验2少可知实验3中酸不足,实验3最后得到的应为K
2SO
4和KHCO
3混合溶液;
利用第一步计算结果,则8.46g混合物中含K
2CO
3:
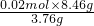
=0.045mol,含KHCO
3:
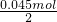
=0.0225mol;
根据原子守恒知产物中K+:0.045mol×2+0.0225mol=0.1125mol,其中KHCO
3:0.045mol+0.0225mol-0.03mol=0.0375mol,K
2SO
4:
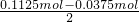
=0.0375mol;
则硫酸物质的量浓度为:

=0.75mol/L,
故答案为:2:1,0.75mol/L.
点评:本题考查制备实验方案的设计、物质的量的有关计算等知识点,注意根据已知信息进行解答结合原子守恒进行解答,难度较大.

 K2CO3+CO2↑+H2O 碳酸氢钾或氢氧化钾 通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水 2:1 0.75
K2CO3+CO2↑+H2O 碳酸氢钾或氢氧化钾 通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水 2:1 0.75 K2CO3+CO2↑+H2O,故答案为:2KHCO3
K2CO3+CO2↑+H2O,故答案为:2KHCO3 K2CO3+CO2↑+H2O;
K2CO3+CO2↑+H2O;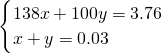 解得x=0.02,y=0.01;
解得x=0.02,y=0.01;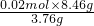 =0.045mol,含KHCO3:
=0.045mol,含KHCO3: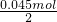 =0.0225mol;
=0.0225mol;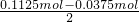 =0.0375mol;
=0.0375mol; =0.75mol/L,
=0.75mol/L,