
一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:


则该反应的△H 0(选填“>” 或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ.mol-1
CO2(g)+C(s)=2CO(g) △H2=+172.5kJ.mol-1
S(s)+O2(g)=SO2(g) △H3=-296.0kJ.mol-1
请写出CO除SO2的热化学方程式 。
 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
,H2的平均生成速率为
。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
,H2的平均生成速率为
。
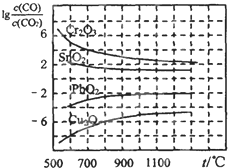
(4)下图中图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
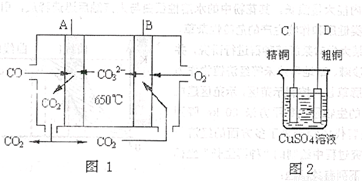
回答下列问题:
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
(1)<
(2) 2CO(g)+SO2(g)=S(s)+2CO2(g) 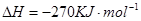 (3分)
(3分)
(3) 75% 0.045mol L-1min-1
L-1min-1
(4)CO-2e-+CO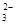 =2CO2
(3分) ‚D
ƒ增加6.4g(不写“增加”也给分)
=2CO2
(3分) ‚D
ƒ增加6.4g(不写“增加”也给分)
【解析】(1)根据方程式可知,升高温度平衡向逆反应方向方向移动,所以正反应是放热反应。
(2)考查盖斯定律的应用。根据反应①C(s)+O2(g)=CO2(g)、反应②CO2(g)+C(s)=2CO(g)反应③S(s)+O2(g)=SO2(g)可知,①-②-③即得到2CO(g)+SO2(g)=S(s)+2CO2(g),所以反应热是-393.5kJ.mol-1-172.5kJ.mol-1+296.0kJ.mol-1=-270 kJ.mol-1.
(3)设CO的转化率是x,则生成CO2和氢气是0.60x。所以根据平衡常数的表达式可知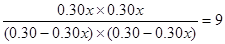 ,解得x=0.75.
,解得x=0.75.
(4)①A电极通入的是CO,所以A是负极。电极反应式为CO-2e-+CO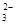 =2CO2。
=2CO2。
②B是正极,则和粗铜相连,即和D相连。
③标准状况下2.24LCO是0.1mol,转移电子是0.2mol,所以析出铜是0.1mol,即质量增加6.4g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H| cCO23 |
| cCO3 |
| cCO23 |
| cCO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.| 50~80℃ |
| 180~200℃ |
| c(CO) |
| c(CO2) |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 180-200℃ |
| c(CO) |
| c(CO2) |

查看答案和解析>>
科目:高中化学 来源:2012届江苏省如皋中学高三下学期质量检测化学试卷 题型:填空题
一氧化碳是一种用途相当广泛的化工基础原料。
⑴利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) 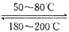 Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
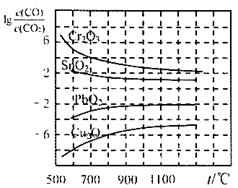
⑵金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下左图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg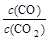 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
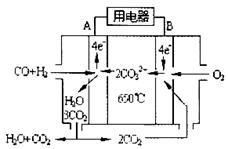
⑶下右图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。依次写出A、B两电极发生反应的电极反应式
__________________________________、___________________________________。
⑷已知:①CO(g)+2H2(g) CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=_______________。
CH3OCH3(g)+CO2(g)的△H=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com