
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 碱性氢氧燃料电池负极的电极反应式:H2-2e-=2H+ | |
| C. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 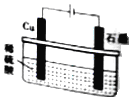 如图所示,反应开始时的离子方程式:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ |
分析 A.碳酸为二元弱酸为弱电解质,部分电离,分步电离;
B.氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水;
C.HCO3-水解生成碳酸和氢氧根离子,该方程式为碳酸氢根离子的电离方程式;
D.铜作阳极,电解质为酸,阳极铜失去电子,阴极上氢离子放电.
解答 解:A.碳酸为二元弱酸分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,故A错误;
B.氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,阳极上氧气得电子和水反应生成氢氧根离子,碱性条件下,负极反应式为H2-2e-+2OH-═2H2O,故B错误;
C.碳酸根离子水解生成碳酸和氢氧根离子,所以HCO3-正确的水解方程式为:HCO3-+H2O?H2CO3+OH-,故C错误;
D.该电解池中,阳极上铜失电子发生氧化反应,Cu-2e-═Cu2+,阴极上氢离子得电子发生还原反应,2H++2e-═H2↑,总反应的离子方程式是Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及多元弱酸的电离、氢氧燃料电池、水解方程式、电解等知识,充分考查了学生规范答题的能力,注意熟练掌握常见化学用语的概念及书写原则.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 制取乙炔,为了降低反应速率可用饱和食盐水代替水 | |
| B. | 除去乙烷中混有的少量乙烯,可用高锰酸钾溶液 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当容器中混合气体的压强不再变化时,反应达到平衡 | |
| B. | 平衡后加入少量W,逆反应速率增大 | |
| C. | 平衡后升高温度,平衡逆向移动 | |
| D. | 平衡后加入X,△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸是弱酸,浓硝酸是强酸 | |
| B. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则通常使金属钝化 | |
| C. | 浓硝酸、稀硝酸和浓硫酸都是强氧化剂 | |
| D. | 室温下,铜既可与浓硝酸反应,又可与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
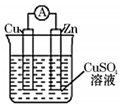
| A. | 锌棒为负极 | B. | 锌棒发生氧化反应 | ||
| C. | 反应后铜棒质量增重 | D. | 电子从铜棒经外电路流向锌棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡放出,该气体是O2 | |
| D. | 氯水放置数天后酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com