
| A. | 氮气的结构式:N=N | B. | F-的结构示意图: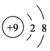 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3 的电子式: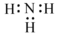 |
分析 A、氮气中氮原子间为三键;
B、氟离子的核外有10个电子,核内有9个质子;
C、质量数写在原子符号的左上角,且质量数=质子数+中子数;
D、氨气中N原子上有一对孤对电子.
解答 解:A、氮气中氮原子间为三键,故氮气的结构式为N≡N,故A错误;
B、氟离子是由氟原子得一个电子形成的,故核外有10个电子,核内有9个质子,故氟离子的结构式为 ,故B正确;
,故B正确;
C、质量数写在原子符号的左上角,且质量数=质子数+中子数,故中子数为20的氯原子的质量数为37,则符号为3717Cl,故C错误;
D、N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,故D错误.
,故D错误.
故选B.
点评 本题考查了常见化学用语,应注意共价化合物电子式的书写和离子的结构示意图的书写,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
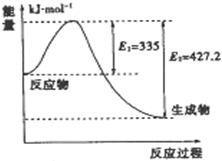 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2和CO2反应中,Na2O2既是氧化剂又是还原剂 | |
| B. | Na2O2、Cl2、SO2使品红溶液褪色的原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 | |
| D. | 在Na2O2中阴阳离子所含的电子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
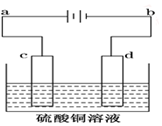 电解装置如图所示:
电解装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
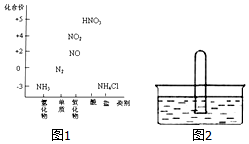 图1为氮及其化合物的类别与化合价对应的关系图.
图1为氮及其化合物的类别与化合价对应的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol | |
| B. | 达到化学平衡状态时,X、Y、Z的浓度不再发生变化 | |
| C. | 达到化学平衡状态时,反应放出的总热量可达a kJ | |
| D. | 升高反应温度,逆反应速率增大,正反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com