
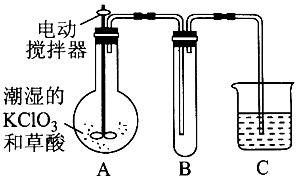
分析 (1)Na2FeO4具有强氧化性,被还以为铁离子,Fe3+和 Al3+一样会发生水解,生成絮状的Fe(OH)3 胶体,胶体会吸附杂志而生成沉淀,从而达到净水的目的;
(2)①根据反应物和产物结合原子守恒来书写方程式;
②二氧化氯的沸点低,B装置应降低温度;
③C装置导气管插入溶液易引起倒吸;
④二氧化氯具有氧化性,在酸性环境下,能将碘离子氧化;加入的指示剂为淀粉,淀粉遇单质碘变蓝,则单质碘反应完,则溶液颜色由蓝色变为无色,达到滴定终点;根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:(1)Na2FeO4中铁元素化合价+6价具有强氧化性,能杀菌、消毒,高铁酸钠的还原产物是Fe3+,Fe3+可发生水解,生成Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果,
故答案为:具有强氧化性,还原产物Fe3+发生水解生成Fe(OH)3胶体,能吸附悬浮物;
(2)①加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为:2KClO3+H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
故答案为:2KClO3+H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+2ClO2↑+CO2↑+H2O;
②二氧化氯的沸点低,B装置应降低温度,补充冷凝装置,B部分还应补充的装置为冰水浴(或冷水浴);因为ClO2的沸点低,有利于凝聚收集,
故答案为:冰水浴(或冷水浴);因为ClO2的沸点低,有利于凝聚收集;
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是C,应防止倒吸,可以连接干燥管吸收,装置图为: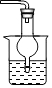 ,
,
故答案为:C; ;
;
④二氧化氯具有氧化性,在酸性环境下,能将碘离子氧化,反应的原理方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
加入的指示剂为淀粉,淀粉遇单质碘变蓝,则单质碘反应完,则溶液颜色由蓝色变为无色,达到滴定终点;
设原ClO2溶液的浓度为x,准确量取ClO2溶液10.00mL,稀释成100.00mL试样,则浓度变为:$\frac{x}{10}$,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{x}{10}$×V1×10-3mol 1×10-3cV2mol
x=$\frac{2mol×1{0}^{-3}c{V}_{2}mol}{10mol×\frac{{V}_{1}}{10}×1{0}^{-3}mol}$=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=67.5g/mol×$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g•L-1,
故答案为:8H++2ClO2+10I-=5I2+2Cl-+4H2O;溶液由蓝色变为无色,且半分钟内不变色;$\frac{135c{V}_{2}}{{V}_{1}}$.
点评 本题考查实验方案的设计,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题关键,难度中等.计算时要注意二氧化氯浓度的变化.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题

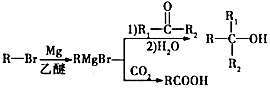
 ,其反应类型为取代反应.
,其反应类型为取代反应. .
. (写结构简式).
(写结构简式).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)
纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
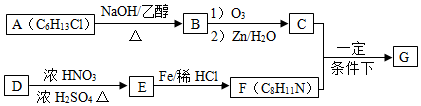
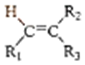 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+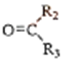
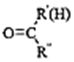 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$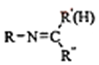 +H2O
+H2O .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).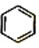 $\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$
$\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$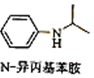
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com