
X、Y、Z、W、R属于短周期主族元素。X的原子半径在短周期主族元素中最大,Y核素的最外层电子数为m,次外层电子数为n, Z原子的L层电子数为m+n, M层电子数为m-n≠0 , W与Z同主族,R与Y的核外电子数之比为2:1,下列叙述错误的是( )
A. X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2
B. Y的氢化物比R的氢化物稳定,沸点高
C. Y分别与Z、W、R以两种元素组成的常见化合物有3种
D. Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z
科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:选择题
过氧乙酸(CH3COOOH)的制备反应为:CH3COOH +H2O2 CH3COOOH+H2O,下列有关该反应的说法正确的是
CH3COOOH+H2O,下列有关该反应的说法正确的是
A. 当消耗CH3COOH的速率与消耗H2O2的速率相等时,反应达到限度
B. 达反应限度时,CH3COOH、H2O2、CH3COOOH的浓度均不再变化
C. 达反应限度时,CH3COOH不再与H2O2发生反应
D. 若在反应中适当降低CH3COOH浓度,可提高反应速率
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:实验题
已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
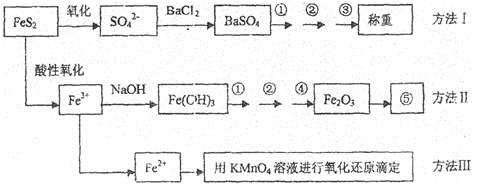
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A.砝码生锈 | B.定容时俯视 |
C.称量时物质和砝码位置反了(需要游码) | D.容量瓶用待装液润 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:选择题
化学与人们的生活、健康密切相关.下列做法不合理的是( )
A. 用米汤检验加碘食盐中的碘酸钾(KIO3)
B. 向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C. 用灼烧和闻气味的方法区别棉织物和纯毛织物
D. 向污水中加入适量明矾,可除去其中的悬浮物
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三二诊模拟考试理综化学试卷(解析版) 题型:填空题
火力发电厂释放出大量氮氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理.可实现绿色环保、低碳减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为______。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
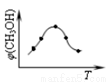
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图),则上述CO2转化为甲醇反应的△H3______0(填“>”、“<”或“=”)。
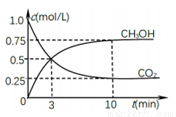
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:0~10min内,氢气的平均反应速率_____;第10min后,若升温,将使c(CH3OH)/c(CO2)_____(填“变大”、“减小”、“不变”);判断理由是_________;若向该容器中再充入1molCO2和3molH2,再次达到平衡时,则CH3OH(g)的体积分数将_________(“变大”、“减小”、“不变”)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为___________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由小到大的顺序为________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:填空题
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)铜原子在基态时的价电子排布式为__________。金属铜的结构形式为面心立方最密堆积,晶胞中每个铜原子周围最近的铜原子有________个。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度 加以解释_______________________。
(3)GaC13和AsF3的空间构型分别是:_________,_______。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________;
②[B(OH)4]-的结构式为_________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
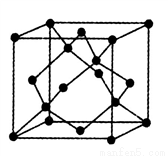
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______________(用化学式表示);
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm (1pm=10-12m)。立方氮化硼的密度是______g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
短周期主族元素W、X、Y、Z的原子序数依次增大。W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半。下列叙述正确的是
A. 原子半径:Y>Z
B. 金属活动性:X<Y
C. 最简单氢化物的热稳定性:Z>W
D. Y元素的氧化物不溶于X元素最高价氧化物对应水化物的水溶液
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:简答题
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
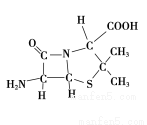
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
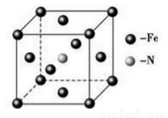
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。已知X是组成化合物种类最多的元素,并与Y同同期,Y的最外层电子数是其电子层数的3倍,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有一个电子。下列说法正确的是( )
A. 最高价氧化物对应水化物的碱性:Z<W
B. 原子半径:Z>X
C. 气态氢化物的稳定性:X>Y
D. Y与Z能形成共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com