
 .
.分析 前四周期原子序数依次增大的元素A、B、R、D中,A为电负性最大的元素,则A为F元素;B为前四周期第一电离能最小的元素,则B为K元素;R和D与B位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且R和D的原子序数大于K,R的原子序数小于D,则R是Fe元素,D是Ni元素;
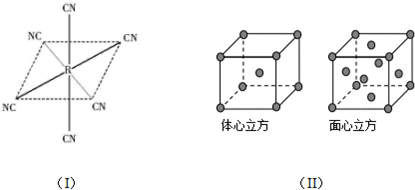
(5)①由图可知,Fe2+的配体数目为6,配体CN-与N2互为等电子体,CN-与N2结构相似,CN-中C、N原子之间形成C≡N键;
②根据均摊法计算体心立方密堆积、面心立方密堆积晶胞原子数目;
③FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,这说明氯化铁形成的晶体是分子晶体,而FeF3晶体熔点高于1000oC,这说明氟化铁形成的晶体类型是离子晶体.
解答 解:前四周期原子序数依次增大的元素A、B、R、D中,A为电负性最大的元素,则A为F元素;B为前四周期第一电离能最小的元素,则B为K元素;R和D与B位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且R和D的原子序数大于K,R的原子序数小于D,则R是Fe元素,D是Ni元素.
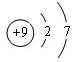
(1)元素 A为F元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素 A 和 B 形成的化合物为KF,由活泼金属与活泼非金属性组成,其晶体类型为离子晶体,故答案为:离子晶体;
(3)元素 D为Ni,基态原子价电子排布式为3d84s2,故答案为:3d84s2;
(4)酸性条件下,Cr2O72-(产物为 Cr3+)能将 Fe2+氧化为 Fe3+,反应离子方程式是:Cr2O72-+6 Fe2++14 H+=2 Cr3++6 Fe3++7 H2O,
故答案为:Cr2O72-+6 Fe2++14 H+=2 Cr3++6 Fe3++7 H2O;
(5)①由图可知,Fe2+的配体数目为6,配体CN-与N2互为等电子体,CN-与N2结构相似,CN-中C、N原子之间形成C≡N键,1mol Kn[R(CN)m]的配离子含有12molσ键,含有σ键数目为12NA,
故答案为:12NA;
②体心立方密堆积晶胞中含有原子数目为1+8×$\frac{1}{8}$=2,面心立方密堆积晶胞中含有原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,两种晶胞中含有原子数目组织部为2:4=1:2,
故答案为:1:2;
③FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,这说明氯化铁形成的晶体是分子晶体,而FeF3晶体熔点高于1000oC,这说明氟化铁形成的晶体类型是离子晶体,因此两种化合物熔点差异较大的原因是FeF3为离子晶体,FeCl3为分子晶体,
故答案为:FeF3为离子晶体,FeCl3为分子晶体.
点评 本题是对物质结构和性质的考查,正确推断元素是解本题关键,题目涉及核外电子排布、化学键、配合物、晶胞结构、晶体类型与性质等,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:推断题
 ,M中阴离子的离子符号为O22-.
,M中阴离子的离子符号为O22-. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为非金属元素 | D. | 丁一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
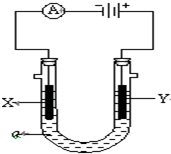 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com