
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.6mol/L | D. | 0.3mol/L |
分析 设0.4mol/L AgNO3溶液,0.3mol/L MgCl2溶液和0.2mol/L的AlCl3溶液按3L:2L:1L,计算混合液中含有的氯离子总数,银离子总数,结合Ag++Cl-=AgCl↓,计算反应后剩余氯离子物质的量,依据C=$\frac{n}{V}$计算剩余氯离子物质的量浓度.
解答 解:设0.4mol/L AgNO3溶液,0.3mol/L MgCl2溶液和0.2mol/L的AlCl3溶液按3L:2L:1L,则银离子物质的量为:0.4mol/L×3L=1.2mol,含有氯离子物质的量为0.3mol/L×2×2L+0.2mol/L×3×1L=1.8mol,依据Ag++Cl-=AgCl↓,反应后剩余氯离子物质的量为:1.8mol-1.2mol=0.6mol,氯离子物质的量浓度为$\frac{0.6mol}{6L}$=0.1mol/L,
故选:B.
点评 本题考查了物质的量浓度有关计算,侧重考查混合溶液离子浓度计算,明确混合过程中银离子与氯离子反应,准确计算反应后剩余氯离子物质的量为解题关键,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中只有第2列元素的原子最外层有2个电子 | |
| B. | 除短周期外,其他周期均有 18 个元素 | |
| C. | 副族元素中没有非金属元素 | |
| D. | 碱金属元素是指ⅠA 族的所有元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当沉淀恰好消失时c(Cl-)=3c(Al3+) | |
| B. | 若将反应后的溶液与原NaAlO2溶液混合,则恰好为中性 | |
| C. | NaAlO2溶液中离子浓度大小顺序为:c(AlO2-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当c(Na+)=c(Cl-)时沉淀量达到最大值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法不正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法不正确的是( )| A. | 可以用水代替SO(CH3)2做溶剂 | |
| B. | 电子移动方向是由a极流向b极 | |
| C. | 该装置将化学能转化为电能 | |
| D. | b极反应式为FeS2+4Li++4e-═Fe+2Li2S |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
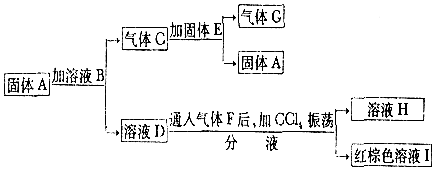
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生白色沉淀,一定有Ag+或SO42- | |
| B. | 加入AgNO3溶液产生白色沉淀,一定有Cl-或CO32- | |
| C. | 加入Ba(NO3)2和稀硝酸仍然有白色沉淀,一定有SO42- | |
| D. | 加入盐酸酸化,无现象,再加入BaCl2溶液产生白色沉淀,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥厂、冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| B. | 过多的汽车尾气排放物容易造成雾霾、酸雨和光化学污染等环境污染问题 | |
| C. | 碳酸钾有一定的去污能力,在热水中去污能力更强 | |
| D. | 在船底镶嵌锌块以保护船体的方法叫阴极电保护法,利用的是原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com