
【题目】向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
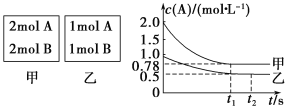
(1)乙容器中,平衡后物质A的转化率为________
(2)x=________
(3)T ℃时该反应的平衡常数为________
(4)下列说法中正确的是
A.向平衡后的乙容器中充入氦气可使重新达到平衡时的c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中A的浓度范围为0.78 mol·L-1<c(A)<1.56 mol·L-1
【答案】(1)50%
(2)1
(3)2
(4)C
【解析】
试题分析:(1)乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,根据A和B的关系式知,参加反应的B的物质的量也是0.5mol,则B的转化率=![]() ×100%=50%。
×100%=50%。
故答案为:50%;
(2)甲容器反应达到平衡后,c(A)=0.78 molL-1,A的转化率=![]() =61%,乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,A的转化率=
=61%,乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,A的转化率=![]() =50%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,则x=1。
=50%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,则x=1。
故答案为:1;
(3)反应达到平衡时,乙容器中c(A)=c(B)=c(C)=0.5 molL-1,T℃时,该反应的平衡常数K=![]() =
=![]() =2。
=2。
故答案为:2;
(4)A.向平衡后的乙容器中充入惰性气体氦气,气体的浓度不变,平衡不发生移动,所以c(A)不变,故A错误;B.将乙容器单独升温,平衡逆向移动,A的体积分数增大,更大于甲容器中A的体积分数,故B错误;C.若向甲容器中再充入2 mol A、2 mol B,相当于增大压强,平衡向正反应方向移动,则达到平衡时A的转化率比不加前增大,所以平衡时甲容器中0.78 molL-1<c(A)<1.56 molL-1,故C正确。
故答案为:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | |||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | 温度℃ | |
① | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
(1)写出该反应的化学方程式 。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=_____________mol·L-1·min-1。
(4) 若保持其他条件不变,下图两条曲线分别表示20℃和40℃时c(MnO)~反应时间t的变化曲线。40℃时c(MnO)~t的变化曲线为 。(填写A或B)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种治疗心血管疾病的药物,它的合成路线如下:
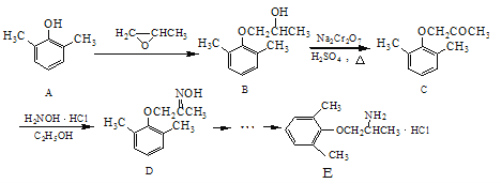
(1)C分子中含氧官能团的名称为_________________。
(2)由B→C的反应类型为_____________。
(3)由A制备B的过程中有少量副产物F,它与B互为同分异构体,E的结构简式为___________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:___________。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(5)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚 (
)。写出以邻甲基苯酚 ( 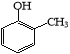 )和乙醇为原料制备
)和乙醇为原料制备 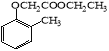 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、干燥,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙胆酸甲酯是制取抗心律失常药物——氟卡尼的中间体。
I.已知龙胆酸甲酯结构如图所示:
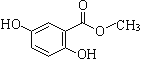
(1)龙胆酸甲酯的官能团名称为 。
(2)下列有关龙胆酸甲酯的描述,不正确的是 (填字母)。
A.难溶于水
B.不能发生消去反应
C.能与溴水反应
D.遇FeCl3溶液能显红色
E.能与碳酸氢钠溶液反应产生二氧化碳
(3)1摩尔龙胆酸甲酯与足量的NaOH溶液反应,最多消耗NaOH mol 。
II.已知X及其他几种有机物存在如下转化关系,且测得A中含三个甲基:
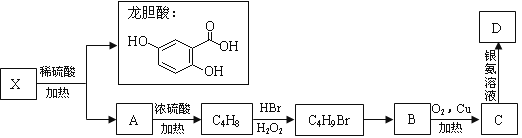
说明:不对称烯烃与卤化氢发生加成反应主要产物遵循以下规则马氏规则:通常情况下,氢加到含氢多的不饱和碳原子一侧反马氏规则:在过氧化物作用下,卤原子加到含氢多的不饱和碳原子一侧
回答以下问题:
(4)X的结构简式为 。
(5)B的系统命名是___________________________ 。
(6)写出C生成D的化学方程式 (用结构简式表示)。
(7)写出满足下列条件的龙胆酸的一种同分异构体的结构简式 。
①能发生银镜反应
②能使FeCl3溶液显色
③酯类
④苯环上的一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质由于温度不同而能发生不同氧化还原反应的是( )
A. 大理石与盐酸 B. NaOH与AlCl3溶液 C. Zn与H2SO4溶液 D. Fe与浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
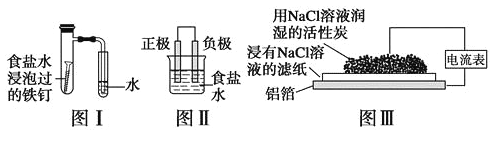
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
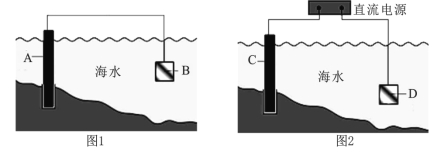
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
该电化学保护方法的名称是 。
(2)图2中,钢闸门C为 极,用氯化钠溶液模拟海水进行实验,D为石墨块,总反应的离子方程式为 。
(3)有关上述实验,下列说法正确的是 。
A.溶液中Na+向D极移动
B.从D极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)模拟工业上离子交换膜法制烧碱的方法,可用如图装置电解硫酸钾溶液来制取H2、O2、H2SO4和KOH。
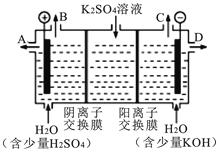
①该电解槽的阳极反应方程式为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”) 导出。
③若采用CH4燃料电池(石墨为电极,KOH为电解质溶液)为电源,则该电池的负极电极方程式为 ,若B极产生标准状况下22.4 L气体,则理论上需要通入 mol CH4。
④电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com