
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
②NH3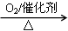 NO
NO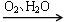 HNO3
HNO3
③NaCl(饱和)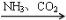 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3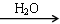 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是
A.门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在
B.铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子
C.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高
D.Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:选择题
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y: 154pm Z:125pm W: 117pm,X Y W位置如图所示(副族省略),
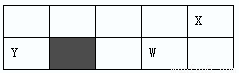
X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y、W的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵中全都是共价键
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-) >c(OH-)>c(H+)
D.N3-与CO2含相等电子数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca (OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图

(1)向沉淀池中要通入CO2和氨气,应选通入______(填化学式)。原因是______________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
B.W与X形成的化合物中只含离子键
C.X、Y、Z、W的原子半径依次减小
D.若W与Y原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:实验题
(12分)高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。如图K10?3是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

图K10?3
(1)制备氯气选用的药品为高锰酸钾和浓盐酸,相应的离子方程式为___________________________。
(2)装置B的作用是________________________,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:______________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入____(选“a”“b”或“c”)。
a | b | c | |
I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是________________________________。该现象________(填“能”或“不能”)说明溴的非金属性强于碘。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列比较不正确的是
A.等浓度的NH4HSO4、 NH3·H2O、 (NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大
B.NaClO和BaCl2混合溶液: c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-)
C.25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol·L-1
D.常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,混合后溶液pH<7,则c(ROH)>c(R+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com